心臓は生命活動を象徴する器官であり,血液を全身に循環させるポンプの役割を成す.
心臓がリズミカルに拍動できるのは,心臓の構成単位である心筋細胞の電気活動と,細胞間の適切な興奮伝播により,心臓全体が電気的に統御されているためである. 心筋細胞は個々の細胞が自ら拍動するという特徴をもつ.
心筋細胞の電気生理学的研究は,約半世紀行われてきた.
心筋活動電位とそれに伴う細胞内イオン濃度変化を再構成し,そのイオン機序を明らかにする試みは1952年頃から始まったが,モデルの構成要素については実験的証明がなされていない点も多かった.
ここ十年余りで理解が急速に進展している. それは,(1)単一心筋細胞標本の確立(2)パッチクランプ法の開発(3)イオンチャネルに関する分子生物学的研究の進展 により,心筋細胞におけるイオンチャネルの分子生理の理解が進んだからである.
しかし,未だ解明されていない機構が数多く存在し,心不全などの十分な理解には至っていない為,今後の研究への期待は大きい. 心臓は自ら反復して興奮し収縮する能力がある。 洞房結節で発生した興奮は、心房→房室結節→ヒス束の順に伝わり、左脚と右脚に分かれ、プルキンエ線維系を経て心室筋に伝わる。
この研究では、興奮収縮カップリングのメカニズムに対する、包括的な理解を目的としている。それぞれのイオンチャネルは単一機能をもつユニットであり、活動電位は、これらのイオンチャネルの総合イオン電流から産出された膜電位の変化である。膜を介したイオン電流は、電位に依存する。イオンチャネルの複雑な機構を理解する為には、モデリングが有効な手段である。 ペースメーキングのメカニズムを考察するにあたり、この機構にとって重要であるとされているいくつかの電流について注目した。それは次のとおりである。 : (i)
IKr チャネル (ii)
Ihac チャネル (iii)
Ist チャネル 2.手法 2.1.in
vivo 実験 in silicoの実験を行うにあたりウサギの洞房結節細胞を用いて, E-4031投与による遅延整流K電流(IKr)ブロックの及ぼす効果を述べた論文を参考にした。このE-4031は、IKだけを特異的にブロックする薬剤であるため、シミュレーションの再現性を検証するには、適切な実験だと言える。
2.2. in
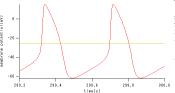
silico 実験 Kyoto modelでは、各イオン電流について、そのコンダクタンス等を調整できる。つまり、細胞の電気活動全体への影響への要素を限定することができる。Krチャネルが、細胞の電気活動にクリティカルかどうか、コンダクタンスの値を調整することにより、活性を変化させた。Krチャネルの式は、以下のようにあらわされている。 Krチャネルのコンダクタンスを5%刻みで減少させた。すると、ある時点で、ペースメイキングがなくなる、という現象がみられた。そこで、その近辺について、1%刻みで現象させた。京都モデルは正常な心筋細胞シミュレーションのための初期値が設定されている。そこで、使用したデータはシミュレーション結果が落ち着く3分から5分後にかけてのものを用いた。 3. 結果 まず、Krチャネルのコンダクタンスを5%刻みでダウンレギュレートし、その結果を検証した。 Krを徐々に減らしたときの、IKrとVmの相関関係を示した曲線は、次の図のようなアトラクタに落ち着く。 コンダクタンスを変化させたところ、ある時点で、自律的な活動電位の有無の分岐が観察された。Krのダウンレギュレートに伴う膜電位の変化はFigure2に示される。 Figure 2 各グラフについて、赤線がKrコンダクタンス100%をあらわす。青線がダウンレギュレート後の膜電位のtraceである。(A)
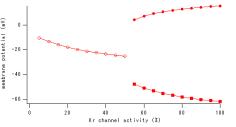
Krコンダクタンスが55%の時の活動電位の様子(縦軸:膜電位(mV)横軸:時間(ms)) (B) Krコンダクタンスが50%の時の活動電位の様子。(縦軸:膜電位膜電位(mV)横軸:時間(ms)) コンダクタンスが50%と55%の活動電位はそれぞれ、Figure2のようになる。後ろの赤線は、正常な状態での活動電位を示す。洞房結節細胞の自律的な活動は、55%では保たれるが、50%では、保たれない。 Figure 3 (A) Krを55%から50%まで1%刻みで落としていったときのKr電流と膜電位の相関関係。 これは、55%と50%の間に、自律的な活動の有無という分岐点があることを示唆している。その点を探し、どのような過程を経て、自律的な活動がなくなっていくのか、55%と50%の間を検証した。1%刻みでコンダクタンスをダウンレギュレートした。すると、53%と54%の間に、挙動が変わる点があると思われる結果がでた。 3.1.分岐解析 膜電位とペースメイキングの有無について検証する。活動電位は、どの範囲をとり得るのか、活動電位の最大値と最小値、ペースメイキングの有無についてのダイアグラムを以下に示す。 Figure 4 Krを100%0%まで5%刻みで落としていったときのKr活性と膜電位のとり得る範囲の相関関係を示す。周期的な拍動がおこっているとき(pacemaking+)の最大膜電位(●)、最小膜電位(■)。おこってないとき(pacemakingー)には○でプロットしている。
(横軸:Krチャネルの活性、縦軸:膜電位(最大、最小膜電位))。 最大膜電位は、活性が下がると共に徐々に下がり、最小膜電位は徐々に上がる。全体として、活動電位の振幅が徐々に狭まっていく。ある時点にいくと、活動電位が停止し、一点に収束したままとなる。 5.考察 モデルと十分な時間シミュレーションすると、ある一定の活動電位に落ち着く。IKrは比較的広い範囲の値をとる電流であり、膜電位形成に与える影響は大きい。参考にしたの論文では、10個中5個の細胞についてはペースメイキングを維持しているが、4つについては、ペースメイキング機能をもたないちという現象が起きている。シミュレーション実験では、わずかなコンダクタンスの違いから、膜電位の分岐現象につながる。 Krの in vivo experimentと同じような分岐点が存在することが示されている。この数値の差は個々の違い個体差に依存する可能性もある。一方で、1%のコンダクタンスによって分岐点がある。 これは、動物種の違いによる、因子リコといんびぼ実験の同じ成果であることもありえる。コンダクタンスや活動電位持続時間、活動周期などの値の裏付けとなるものはないものの、シミュレーション実験による結果は、Krの機能を明確にする。シミュレーションによるとKr電流は自律的活動に不可欠であることを示している。 5. 展望 まず、in
silicoとin vivoの実験結果において、アクティビティが違うという結果がでた。ラットとモルモットという動物種の違いのせいだと思われたが、実際、洞房結節のモデルを構築する際に参考にされている実験データはラットのものが多い。また、コンダクタンスをダウンレギュレートした際の、活動電位の特徴が異なるという問題点もある。今後は、これらの点についてさらに言及していく予定である。 Recent Presentation “An Electrophysiological Simulation
Model of the Myocardial Cell Using E-CELL System” Sayaka
Ishinabe, Yasuhiro
Naito, Motohiro Yoneda, Katsuya Kawai,Shoko Miyamoto, Shinobu Kuratomi, Nobuaki
Sarai, Satoru Matsuoka, Akinori Noma, Masaru Tomita Chem-Bio
Informatics Society(情報計算化学生物学会) 『E-CELL Systemにおける心筋細胞 洞房結節モデルを用いたin silico 実験』 石鍋沙耶花,内藤泰宏,米田元洋,宮本章子,皿井伸明,松岡達,野間昭典,冨田勝 日本分子生物学会 1. 研究背景
1.1. 自動能
1.2. ペースメーカーメカニズムの解析
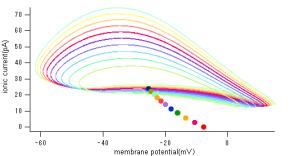
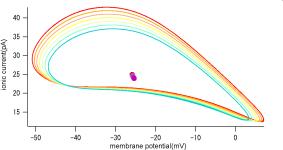
Figure 1 (A) Krを5%刻みで落としていったときのKr電流と膜電位の相関関係。
Tracing(A)は、Krチャネルコンダクタンスを100%から0%まで5%刻みでダウンレギュレートした際のIKrとVmの相関関係を表したアトラクタである。Krのコンダクタンスを50%ダウンレギュレートすると、KrとVmの相関は、一点に収束している。これは、活動電位がなくなり、電位が一定の値に落ち着いていることを示している。すなわち、自律的な活動の停止を意味してい