 今期,膵島β細胞において,Magnus Gerhard氏([1][2][3])のモデルの一連の移植作業においてほぼ成功を収める事ができた.
よって,薬物とイオンチャネル間に対する細胞の影響について実験を試みた.
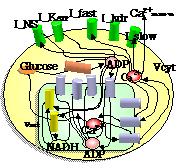
膵島β細胞の静止膜電位(-70mV)はATP感受性Kチャネル(KATPチャネル)の開閉に依存している.[7]グルコース投与に伴い,グルコースは細胞内に取り込まれ代謝され,細胞内free ATP/ADP比を上昇させる.この比率の増加は結果としてKATPチャネルを閉鎖させ脱分極を引き起こす.ついでこの脱分極は電位依存性Ca2+チャネルを開口させ細胞内Ca2+が上昇し,それが直接のトリガーとなり細胞内のインスリン顆粒が細胞外に放出される.糖尿病治療薬であるスルホニルウレアは直接KATPチャネルを閉鎖させ細胞内ATP増加と同等の効果をもたらす.[7][8]
今期,膵島β細胞において,Magnus Gerhard氏([1][2][3])のモデルの一連の移植作業においてほぼ成功を収める事ができた.
よって,薬物とイオンチャネル間に対する細胞の影響について実験を試みた.
膵島β細胞の静止膜電位(-70mV)はATP感受性Kチャネル(KATPチャネル)の開閉に依存している.[7]グルコース投与に伴い,グルコースは細胞内に取り込まれ代謝され,細胞内free ATP/ADP比を上昇させる.この比率の増加は結果としてKATPチャネルを閉鎖させ脱分極を引き起こす.ついでこの脱分極は電位依存性Ca2+チャネルを開口させ細胞内Ca2+が上昇し,それが直接のトリガーとなり細胞内のインスリン顆粒が細胞外に放出される.糖尿病治療薬であるスルホニルウレアは直接KATPチャネルを閉鎖させ細胞内ATP増加と同等の効果をもたらす.[7][8]
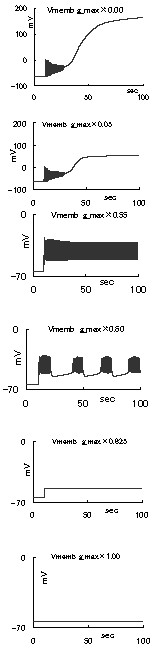 4 方法
4 方法