2005年度森泰吉郎記念研究振興資金 研究者育成費成果報告書
同位体標識を利用した大腸菌細胞の代謝流束解析
政策・メディア研究科 戸谷吉博
要旨
本研究では,大腸菌BW25113の中心炭素代謝経路の一遺伝子欠損株(25株),および生育条件(希釈率)を変更して培養した野生株の代謝流束分布の推定を行った.基質として13Cでラベルされたグルコースを用い,培養した菌体を加水分解し,得られたアミノ酸の質量分布をGC/MSで測定し,流束の計算に用いた.また,希釈率を変更した培養菌体については,同時にCE/TOFMSで細胞内の遊離の代謝産物の質量分布を測定し,流束の計算に用いた.希釈率を変更した培養菌体については,加水分解物のアミノ酸の質量分布を用いた従来法と,細胞内の遊離の代謝産物を用いた手法を比較し,後者の妥当性を示した.
1.
序論
中心炭素代謝経路とは,Embden-Meyerhof-Parnas(EMP)経路・Pentose-Phosphate(PP)経路・Tri-Carboxylic-acid(TCA)回路からなる経路で,エネルギー代謝の一部である.これらの経路はグルコースなどの糖を取り込み,細胞内反応に利用するATPやNADPHを生成したり,菌体の構成要素を生合成するのに必要な前駆体物質を生成したりすることを目的としている.菌体の挙動を理解する上で,重要なことの一つはエネルギー生産の解析であり,ATPの生産というエネルギーの収支に関して重要な役割を持つ中心代謝経路の解析は重要な課題である.現在,我々はこの経路のダイナミックシミュレーションを行うため,コンピュータモデルを構築するプロジェクトを遂行している(石井, 2003).本プロジェクトが採用しているモデル作成手法では,様々な条件下の大腸菌に関する代謝産物濃度,酵素量などのデータに加えて代謝流束を知る必要がある(岩田, 2005).代謝流束を求める手法は,古くは1980年代から多くの研究者によって研究されており(Aiba and Matsuoka, 1979),その手法の一つに13C同位体標識の利用が挙げられる(Zhao
and Shimizu, 2003).我々はこの手法を用い,代謝流束分布を網羅的に測定するフラクソーム(Sauer,
2004)を行う必要があった.
本研究では,先に述べたモデル作成のため,まず1遺伝子欠損株(馬場, 2004)を用いることで,様々な条件のデータを集めることを計画した.しかし多くの酵素はアイソザイムを持っているため,1遺伝子欠損株では代謝に大きな影響を与えないと考えられた.そこで希釈率を変更した培養も行うことにより,様々な条件下におけるデータを取得することを目的とした.また希釈率を変更した培養においては従来のGC/MSによる代謝流束解析ではなく,CE/TOFMS(Soga, 2003)を用いた新手法を用いて解析を行うことで,従来法との結果の比較を行い,実用化に向けた新手法の検討も目的とした.
CE/TOFMSを用いた解析手法は,従来のアミノ酸の質量分布を観測対象としたGC/MSによる代謝流束解析と異なり,細胞内代謝産物を直接測定する.従来法では流束分布がアミノ酸に影響を与えるのに時間がかかるため,回分培養のような細胞が遷移状態にある際は解析することは不可能とされてきた.しかし,新手法を用いることで回分培養の遷移状態における流束分布の変化を推定出来ると考えている.
またCE/MSを用いた代謝流束解析に関する研究は他に見られない.そのため産業応用において重要である非定常状態の代謝流束解析を可能にする本研究は,代謝流束解析の可能性と実用性を示す上で,新たに大きな貢献が出来ると期待している.
2.
対象と手法
2.1.
菌株と培養法
野生株はEscherichia coli K12 strain BW25113株を使用し,欠損株はKEIOコレクションのEMP経路・PP経路の一遺伝子欠損株を使用した.また培養は無機塩類・微量金属・炭素源・ビタミンからなる合成培地による連続培養を行い,定常状態に到達後(平均滞留時間の3倍の時間経過),流加するグルコースの濃度,全ての炭素原子が標識されたグルコース[U-13C]glucose
0.8g/L,1位の炭素原子が標識されたグルコース[1-13C]glucose 0.8g/L,標識されていないグルコース 2.4 g/L に変更した.
2.2.
代謝産物の質量分布の測定
蛋白質を加水分解して得られたアミノ酸の質量分布の定量にはガスクロマトグラフィー質量分析法(GC/MS)を利用した.GCは揮発性物質の分離に利用される手法である.アミノ酸の場合,ガス化する際には誘導体化を行っている.また,代謝産物の質量分布の定量にはキャピラリー電気泳動質量分析法(CE/MS)を利用した. CEは電気泳動による移動度の違いを利用して分離する手法であり,イオン性の物質の分離に利用される手法である.
2.3.
同位体標識を利用した代謝流束解析方法
12Cと13Cでは質量が異なるため,標識されている炭素数の違いによって,細胞を構成するアミノ酸や細胞内代謝産物などの物質は異なる質量数をもつ.つまりN個の炭素原子から構成される物質はN+1通りの質量数を持つ可能性がある.定常状態において各物質がどのような質量の分布を示すかは,細胞内の代謝流束分布から計算することが可能である.そこで代謝流束分布から計算される物質の質量分布が,質量分析によって測定された物質の質量分布と最も近くなるように,代謝流束分布を遺伝的アルゴリズムによって最適化する.(Wittmann and Heinzle,1999)(Schmid et al.,
1999)(Schmid et
al., 1997)
2.4.
解析対象経路
本研究で解析の対象とする経路をFig.1に,またアミノ酸を構成する前駆体物質をTable 1に記載した.
Table 1 各アミノ酸を構成する前駆体

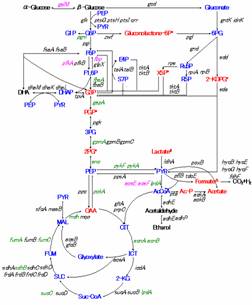
Fig.
1解析対象経路(石井氏作成)
3.
結果と考察
3.1.
GC/MSを用いた遺伝子欠損株の解析
現在13C同位体標識を用いた代謝流束解析では,実測値としてGC/MSで測定された質量分布データとNMRで測定された13C同位体標識の位置情報が用いられている.しかし,NMRのデータは質量分布データに比べて精度が悪く,またデータの測定にも多くの労力を必要としている.そこでGC/MSによって測定された質量分布データのみを実測値として,従来法と同様の結果が得られないか検討した.
解析対象を大腸菌の中心炭素代謝経路の一遺伝子欠損株とし,解析には各種アミノ酸(アラニン,グリシン,バリン,ロイシン,イソロイシン,プロリン,メチオニン,セリン,スレオニン,フェニルアラニン,アスパラギン酸,グルタミン酸,チロシン)のGC/MSの質量分布データ,乾燥菌体重量,細胞外代謝産物(エタノール,L-乳酸,D-乳酸,酢酸)を用いた.最適化に用いた遺伝的アルゴリズムのパラメータは世代数100,個体数30,変異率0.9,交叉率0.4,エリート保存1として行った.結果をFig.1に記載した.結果は横軸に野生株の各流束の値,縦軸に変異株の各流束の値を示している.
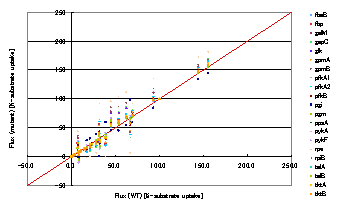
Fig. 1野生株の流速分布と遺伝子欠損株の流束分布の比較
Fig.1の各欠損株について詳細を見ると従来法(GC/MS+NMR法)と同じ結果が得られたものと,異なる結果が得られたものに分けられた.まず従来法と同じ結果が得られた例としてrpe欠損株についてFig.2に記載した.左図は横軸に推定された流束分布を,縦軸に従来法で得られた流束分布を示している.右図は横軸に推定された流束分布から計算された質量分布を,縦軸にGC/MSによって測定された質量分布を示している.左図を見ると多くの点が比例直線上にあることが分かり,従来法と同様の流束分布の推定結果が得られたといえる.右図からは推定された流束分布から計算された質量分布がGC/MSによって測定された質量分布とほぼ同じであることがいえる.
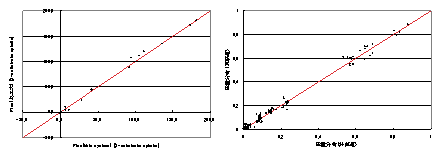
Fig.2 (左)rpe欠損株の流束分布 (右)質量分布の最適化状況
一方,従来法と異なる例としてtalB欠損株について,Fig.3に記載した.rpe欠損株同様に,左図は横軸に推定された流束分布を,縦軸に従来法で得られた流束分布を示している.右図は横軸に推定された流束分布から計算された質量分布を縦軸にGC/MSによって測定された質量分布を示している.左図はFig.2と比較すると幾つかの点が比例直線上から外れていることが分かる.これは従来法と異なる流束分布の推定結果が得られてしまったことを意味する.この結果が示す重要な点は,Fig.3のtalB欠損株においては流束分布が,従来法と異なっているにもかかわらず,GC/MSによるアミノ酸の質量分布データは,Fig.2のrpe欠損株同様に推定された流束分布から説明出来てしまっていることである.
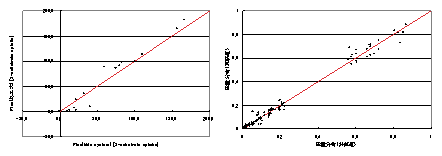
Fig.3 (左)talB欠損株の流束分布 (右)質量分布の最適化状況
ここでtalB欠損株の解析結果が従来法と異なった理由として,計算に用いたアミノ酸の質量分布データにPP経路内の代謝物質を前駆体とするアミノ酸が少ないことが原因であるという仮説を立てた.
PP経路内の代謝物質を前駆体とするアミノ酸の中で,測定対象に該当するアミノ酸は,フェニルアラニンとチロシンのみであり,共にエリトロース4リン酸を前駆体としており,他のPP経路内の物質は前駆体としていない.そこでPP経路内に含まれるリボース5リン酸を前駆体とするヒスチジンを含めた質量分布データを,従来の流束分布の知見から仮想的に作り,そのデータを実験で得られたデータに加えて流束分布の推定を行った.結果をFig.4に記載した.左図は横軸に推定された流束分布を,縦軸に過去に得られている流束分布を示している.右図は仮想的に加えたヒスチジンの質量分布について,横軸に推定された流束分布から計算された質量分布を縦軸にGC/MSによって測定された質量分布を示している.結果はFig.3同様に従来法と異なる流束分布を示すが,推定されるフラックスから計算された質量分布データは,実験データと一致する結果となった(Fig.4).
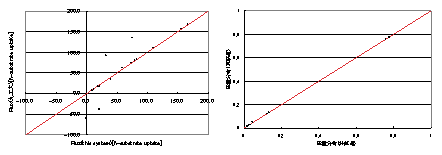
Fig.4 (右) talB欠損株の流束分布 (左)ヒスチジンの質量分布データの最適化度合い
Fig.4の結果から,GC/MSによるアミノ酸の質量分布から推定される流束分布には,実験値を満たす幾つかの解が存在していることが明らかである.そのためGC/MSデータだけでは代謝流束解析を行うのに不十分であり,NMRで測定された13C標識の位置情報のような,他の情報を加えない限り解を絞り込むことは出来ないと結論付けられた.
3.2.
CE/TOFMSを用いた希釈率変更培養の解析
連続培養における希釈率(比増殖速度)を変更して培養を行った野生株大腸菌について代謝流束解析を行った.使用したデータは各種代謝産物(ジヒドロキシアセトンリン酸,3−ホスホグリセリン酸,ホスホエノールピルビン酸,ピルビン酸,リブロース5リン酸,リボース5リン酸,エリトロース4リン酸,マレイン酸)のCE/TOFMSによって測定された質量分布データ,乾燥菌体重量,細胞外代謝産物濃度(エタノール,L-乳酸,D-乳酸,酢酸)である.最適化に用いた遺伝的アルゴリズムのパラメータは世代数100,個体数30,変異率0.9,交叉率0.4,エリート保存1とした.結果をFig.5に記載した.結果は横軸に従来法によって求められた流束分布の値(既知のデータ),縦軸に今回推定された流束分布の値を示している.また各希釈率における最適化状況をFig.6に記載した.Fig.5の結果から,流束分布は従来法と極めて一致していることが分かる.また,Fig.6の各希釈率において,推定された流束分布から計算された質量分布データは,実験データを十分説明出来ているといえる.
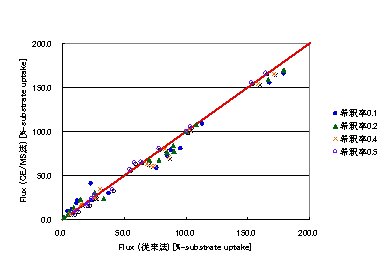
Fig.5 希釈率0.1[h-1],0.2[h-1],0.4[h-1],0.5[h-1]の流束分布の従来法との比較
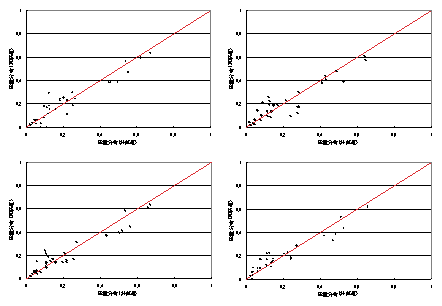
Fig.6(左上)希釈率0.1[h-1](右上)希釈率0.2[h-1](左下)希釈率0.4[h-1],
(右下)希釈率0.5[h-1]の質量分布データの最適化状況
4.
結果と展望
GC/MSを用いた遺伝子欠損株の代謝流束解析によりGC/MSデータのみを用いて代謝流束解析を行うには情報が不十分である可能性が示唆された.またCE/TOFMSを用いた希釈率を変更した培養の代謝流束解析では,GC/MSとNMRを用いた従来法と比較した結果,一致した結果が得られた.このことから,CE/TOFMSを用いた代謝流束解析手法を確立し検証することが出来たと言える.今後の代謝流束解析には,CE/TOFMSを用いた手法を使うことで,精度や煩雑さの問題を抱えたNMRを用いることなく,より簡便に解析を行うことが可能になると期待される.
また,今後はCE/TOFMSを用いた手法によって回分培養おける流束分布の推移を推定したいと考えている.回分培養とは一般に工業利用されている手法で,最初に入れた基質を消費し続ける.そのため回分培養は連続培養と異なり,培養槽内の菌体の状態が一定ではない.細胞構成蛋白質のアミノ酸に着目した従来法では,流束分布がアミノ酸に影響を与えるのに時間がかかるため,回分培養の遷移状態を代謝流束解析するのは不可能とされてきた.そこで細胞内代謝産物を直接測定出来る本手法を用いることで,回分培養の遷移状態における流束分布の変化を推定したい.
謝辞
本研究を進めるに際し,環境情報学部の中山洋一専任講師・政策メディア研究科の平沢敬助手,石井伸佳氏には非常に適切な助言を頂いた.先端生命研の那波幹氏,平井健太氏には培養を行って頂いた.同じく先端生命研の菅原香織氏,五十嵐沙織氏にはCE/TOFMSの測定を行って頂いた.九州工業大学の清水和幸教授には,研究を進めるにあたって指導して頂いた.そして環境情報学部の冨田勝教授には研究する上で最高の環境を与えていただいた.すべての関係者に感謝の意を表したい.
本研究は,経済産業省の産業科学技術プロジェクト「 生物機能を活用した生産プロセスの基盤技術開発」の一環として,新エネルギー・産業技術総合開発機構(NEDO)から委託を受けて実施している.また,文部科学省の科学研究費補助金・特定領域研究(2)「細菌細胞のコンピュータシミュレーション」,文部科学省の21世紀COEプログラム(生命科学分野)「システム生物学による生命機能の理解と制御」の支援を受けている.
参考文献
Aiba S. and Matsuoka M. (1979)Biotechnol.
Bioeng., 21, 1373–1386.
Zhao J. and Shimizu K. (2003)Journal of Biotechnology,
101, 101–117.
Sauer U. (2004)Curr Opin Biotechnol.,15,58-63.
Soga T., Ohashi Y., Ueno Y., Naraoka H., Tomita M. and Nishioka
T. (2003)J Proteome Res,2, 488–494.
Schmidt K., Nielsen J. and Villadsen.
(1999) Journal of Biotechnology,71, 175–190.
Schmidt K., Carlsen M., Nielsen
J. and Villadsen J. (1997) Biotechnology and
Bioengineering,55, 831–840.
Wittmann C. and Heinzle E.
(1999)Biotechnology and Bioengineering,62,739–750.
馬場智哉 and 森浩禎 (2004)Bio ベンチャー,3-4,13-17.
岩田那由太(2005)修士論文
石井伸佳(2003)修士論文