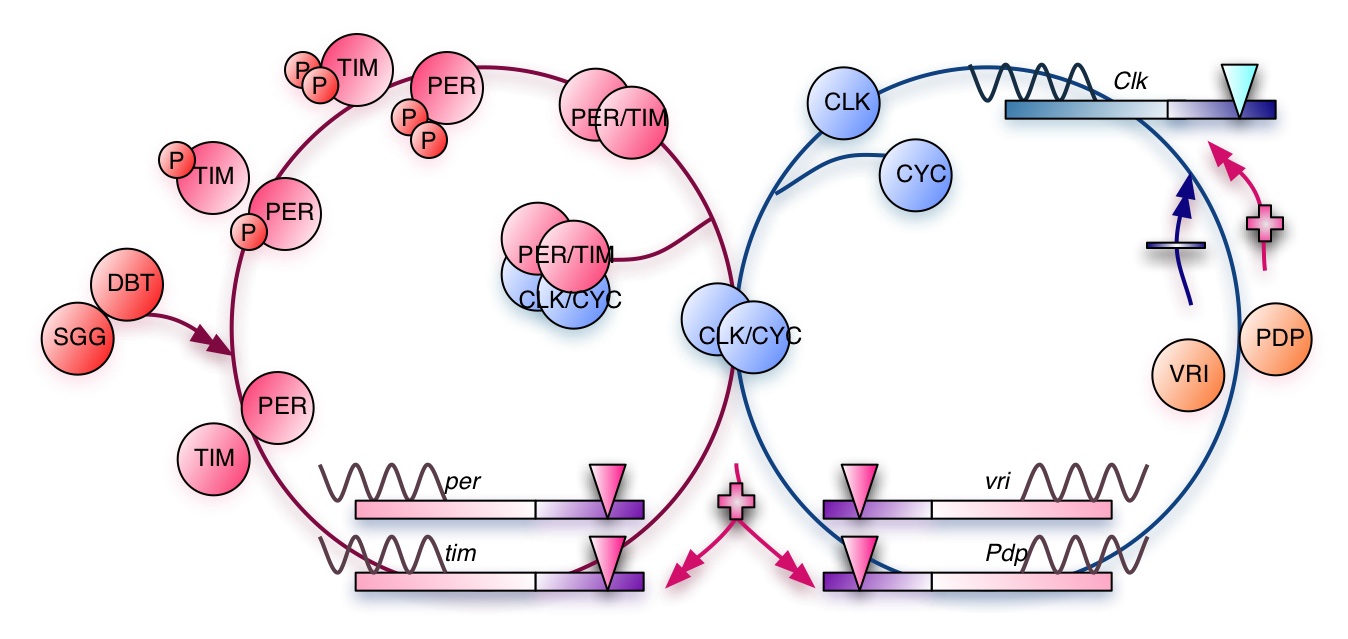
図1. ショウジョウバエ概日時計機構の遺伝子発現制御ネットワーク
2006年度 森泰吉郎記念研究振興基金 研究成果報告書
ショウジョウバエ体内時計の細胞間同調機構の解明
慶應義塾大学 政策・メディア研究科 小川 雪乃
研究課題
多細胞生物においては各細胞間のコミュニケーションが一個体として機能する為に重要である。本研究では地球上の生物において幅広く存在する体内時計(概日時計)に注目し、各細胞に存在する 体内時計がどのようにして同調しているのか、その機構を解明することを目的とする。対象生物は最も良く研究が行われているため情報量が多いショウジョウバエを選び、ゲノム配列解析と分子生物学的実験により得られた同調因子に関する遺伝子発現情報を組み合わせモデルを組み立て、 シミュレーションを行うことで同調機構の推定を行う。
1. 目的
ショウジョウバエにおいて、概日周期振動を生み出す振動体の構成要素とネットワークは概ね決定されており、光同調には光受容体であるCRYPTOCHROME(CRY)が重要な役割を担っている事が明らかにされている(図1)。更に、ショウジョウバエを含む多細胞生物は細胞間同調を行う事で個体単位の時計を構成している事が知られている。細胞間同期のための出力経路の一部は、時計タンパク質による下流の遺伝子発現制御によるものである事が実験的に確認されているが、他の時計からの出力系に対する応答機構についてはほとんど判っていない。そこで、概日時計機構について理解するために必要な次なる段階として細胞間同調の理解を目指す。
細胞間同調機構の解明には、未知の出力系と入力系の構成要素及び相互関係を特定する必要がある。出力系の構成要素を特定するためには実験的アプローチが必要であるが、全く手がかりが無い状態で実験的に探索しようとすると非常にコストがかかる。そこで、既知情報から入力系の受容経路を仮定し振動体モデルを用いたシミュレーションを行う事で、コストの削減をしつつ候補を絞り込む事が可能になる。よって、シミュレーションを用いてショウジョウバエ概日時計の応答機構を推定する事を本研究の目的とする。

2. 時計機構のモデリング
2.1 手法
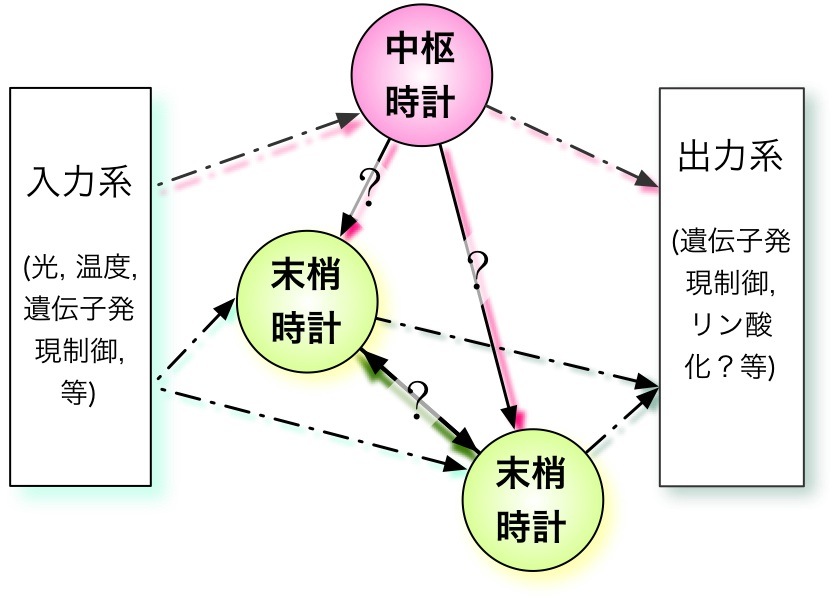
多細胞生物における概日時計は中枢時計と末梢時計の同調、及び隣接する細胞同士の末梢時計の同調によって、一つの個体としての時計を形成している(図2)。ショウジョウバエの中枢時計は8つのラテラルニューロンに存在していると言われており、これらはペースメーカーニューロンと呼ばれる。中枢時計と末梢時計それぞれにおける時計遺伝子の発現状態は異なっているという報告があり、大きな相違点としては光受容体CRYPTOCHROME(CRY)の振動の有無が挙げられる。中枢時計に置いてはCRYタンパク質量が振動していないのに対して、末梢時計では振動するという報告がある。また、CRY変異体において、中枢時計は独自にリズムを刻み続ける事が出来るが、一方で末梢時計はcry mRNAの発現振動が失われる事が知られている( Krishnan B. et al.)。この事から中枢時計と末梢時計では光同調機構に違いがあると考えられる。そこで、まず始めにCRYの発現状態の有無に注目して2種類の時計機構のモデルを構築した。
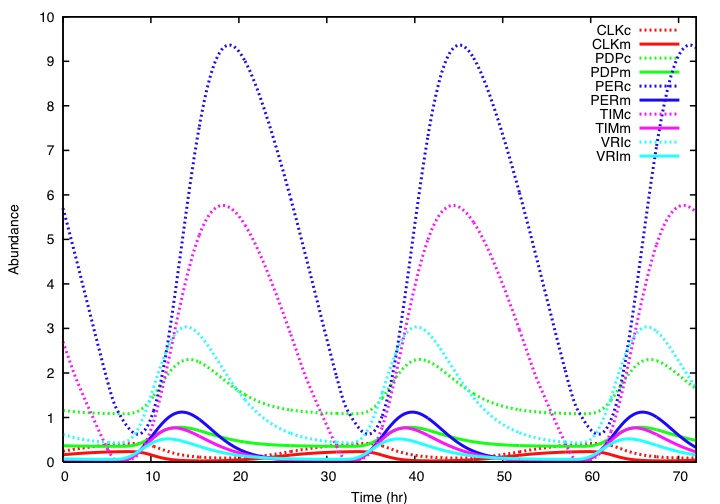
3. 入力系受容機構の推定
3.1 手法
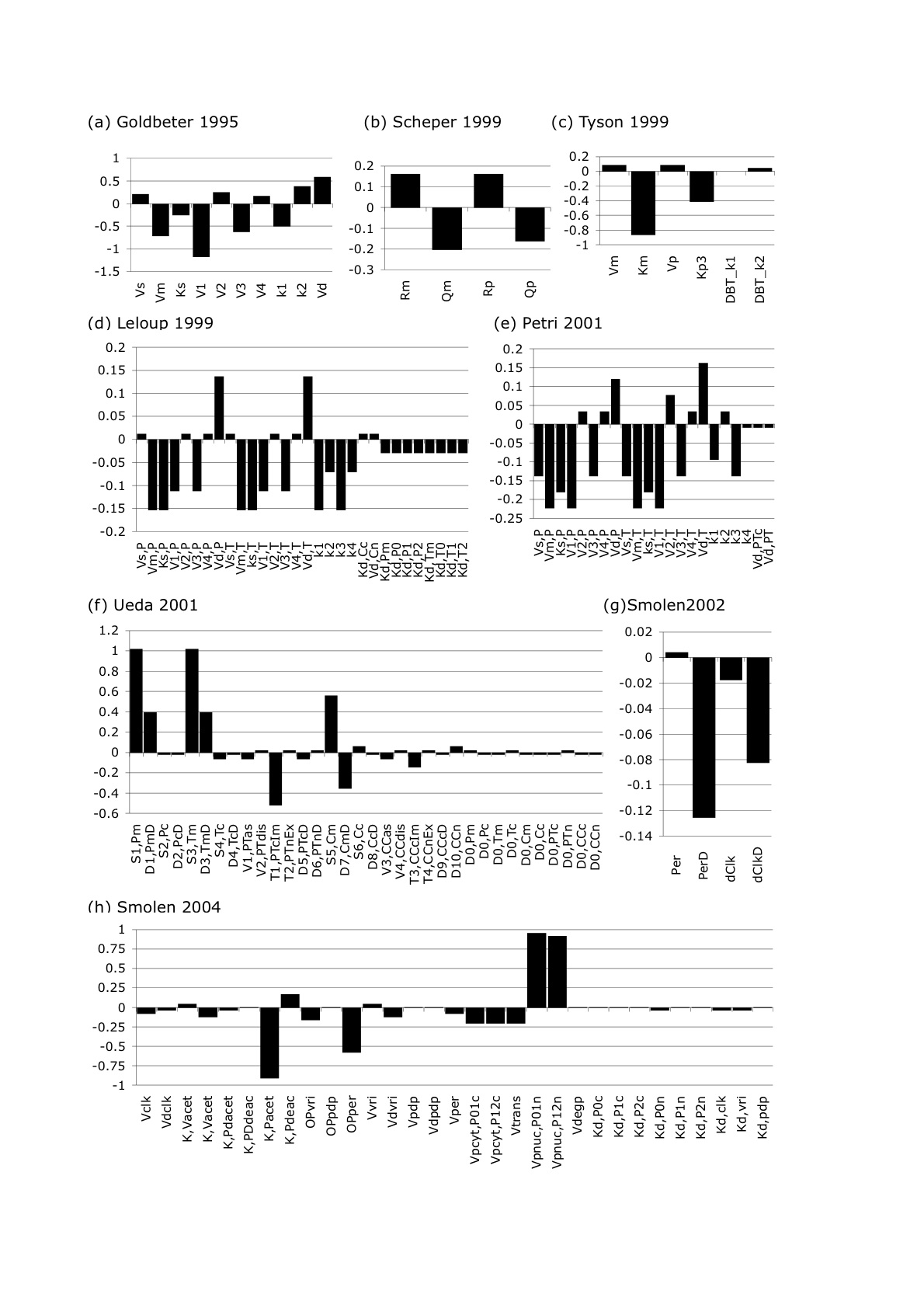
未知である受容機構を推定するために、末梢時計の振動体のモデルに対して入力シグナルを仮定してシミュレーションを行い、周期を調整する事が可能な機構を探索する。末梢時計は複数存在しているが、一つの時計と見なしてシミュレーションを行う。周期を調整する最終的な反応は時計遺伝子の発現制御、ないし時計タンパク質のリン酸化、分解、核内移行、他の時計タンパク質との結合の促進・抑制を目的としたシグナルと時計タンパク質との相互作用である。そこで、全7種の時計遺伝子について以上に挙げた10通りの可能性をシミュレーションし、時計の位相を進める事も遅らせる事も可能であり、受容機構として考えられるパターンを数個に特定する。外部入力を受容して位相シフトを起こす為には、ある程度の感受性が必要であると考えられる。そこで、概日時計の遺伝子発現制御ネットワーク内部の各反応のうちどの反応が摂動に対して感受性が高いのか、またどの反応が摂動に強いのかを解析した。手法はWolfらの振動系ネットワークのの感受性解析を参考に行った(J. Wolf et al., 2005)。ここでは、ショウジョウバエは既存のモデルが数多く存在している事から、8つの既存のモデルを用いた。
3.2 結果
感受性解析の結果、転写反応は最も感受性が強く、その他の反応についてはおおよそ均等に感受性は配分されていることが判った(図4)。光入力によってTIMのタンパク質の分解が促進されて光同調が行われている事が知られているが、TIMはPERは同じ転写制御を受け二量体を形成して転写制御を行っており、この冗長性により分解が促進されても系全体としてのロバストネスが保たれている事が示唆された。光同調と細胞間同調が同じ経路を共有しているか、という点については未だ不明であるが、PERもしくはTIMタンパク質は複数段階のリン酸化制御も受けており、細胞間同調機構の最終的な入力を受けている可能性が高いと考えられる。
3. 議論と展望
中枢時計と末梢時計が同調するという事は、光や温度などの外部入力系とは異なる細胞間情報伝達という内部入力系が存在しているという事を示唆している。中枢時計が末梢時計を同調させるための出力経路は部分的に判っており、ペースメーカーニューロンにおいて振動体の直接的な下流制御を受けているpdf (pigment-disparsing factor)の発現から末梢細胞の細胞膜上の受容体、Nf-1 (Neurofibromin1)の発現とRas/MAPK、cAMP signaling pathwayが存在している事が知られている。また、ペースメーカーからK+チャンネルへの伝達経路を阻害すると同調が失われる事も判っている。しかし、これらの経路がどのように繋がっているのか、同調経路に必要十分であるかついては未だに不明である。
さて、これらの経路が同調にはシグナル伝達レベルと遺伝子発現レベルが混在しており、遺伝子発現レベルと比較するとシグナル伝達の速度は無視できる程度に速い。そこで、第一段階として既知の出力経路における遺伝子発現のみを中枢時計モデルに加え、出力経路を表現する。pdfはCLK/CYC二量体によって直接発現制御を受けている出力経路として知られている。つまり、主要な時計遺伝子であるperやtimと同様の機構で発現していると考えられる。そこで、同調機構の第一段階としてpdfの発現を組み込む。PDFの受容体は対象となる末梢時計の膜上にあると言われているため、末梢細胞内部でRas/MAPKシグナル伝達経路、cAMP signaling pathwayが働いているのではないかと考えられる。今後、既知経路を組み合わせて出力経路の候補を挙げ、それぞれについてモデリング及びシミュレーションした結果で過不足について考察し、最適な出力経路を推定していきたい。
参考文献
A. Goldbeter (1995) Proc Biol Sci 261, 319-24
February 28th, 2007
B. Krishnan, J. D. Levine, M. K. S. Lynchi, H. B. Dowse, P Funes, J. C. Hall, P. E.Hardin and S.E.Dryer (2001). NATURE, 411, 313-317
H. R. Ueda, M. Hagiwara, H. Kitano (2001) J Theor Biol 210, 401-6
J. C. Leloup, A. Goldbeter (1999) J Theor Biol 198, 445-59
J. J. Tyson, C. I. Hong, C. D. Thron, B. Navak. (1999) Biophys J 77, 2411-7
J. Wolf, S. Becker-Weimann and R. Heinrich (2005). Systems Biology 2, 35-41
P. Smolen, P. E. Hardin, B. S. Lo, D. A. Baxter, J. H. Byrne (2004) Biophys J 86, 2786-802
T. O. Scheper, D. Klinkenberg, J. van Pelt, C. Pennartz (1999). J Biol Rhythms 14, 213-20