2009年度森基金 報告書
病理変化を考慮した脳内シグナル伝達の解析法の開発
慶應義塾大学大学院 政策・メディア研究科
修士課程2年
学籍番号:80825292 ログイン名:yanasima
簗島 亮次
活動概要
本年度は研究活動として、主に三つの活動を行ってきた。一つ目は病理変化を考慮した脳内シグナル伝達の解析法の研究である。本研究はアルツハイマー型認知症の患者のデータを用いてアルツハイマーによって引き起こされる病理変化のシミュレーションを行った。二つ目の活動は成長による脳内シグナル伝達の状態変化を抽出するためのアルゴリズムの開発である。
研究の内容
・研究の目的
アルツハイマー型認知症 (以下,AD)によって発現が制御されたシグナル分子のネットワークを生成して構成要素と構造の双方の解析を行った.解析にあたり,AD関連遺伝子がコードしているシグナル分子に対応したノードをネットワーク上から除去したAD患者の海馬CA1部位シグナル伝達経路 (以下,ADN)を生成した.
・アルツハイマー型認知症の前提知識
AD の原因物質といわれているアミロイドβ (以下,Aβ)はアミロイド前駆体蛋白(以下,APP)の段階的蛋白分解の結果生成されて恒常的に細胞外に放出される.このAβが何らかの条件によって不溶化し,細胞外で集積・凝集すると神経細胞を傷害する過程が進行し,ADを発症すると考えられている (Iwata et al., 2000).そのため,AβやAPPからAβを生産するために重要なβsecretaseなどのタンパク質分解酵素といった特定の物質の変化に注目した研究が進められている (Hardy and Selkoe, 2002).しかし,系全体の変化に注目された研究は少なくAβが蓄積する機構はわかっておらず,Aβ自体がAD の直接の原因になっているかにも議論がある (Heneka and O'Banion, 2007).
・研究の進め方
本研究ではヒト海馬CA1部位シグナル伝達経路と晩期発症型AD患者の遺伝子発現データを考慮してネットワークを作成し,海馬シグナル伝達においてAD により最も影響を受ける構造の特徴,およびそれを規定する遺伝子発現による制御のメカニズムの解明を目標とした.我々は先行研究で得られている有向グラフで表現された哺乳類海馬CA1部位のシグナル伝達経路と晩期発症型のAD患者の遺伝子発現データを考慮してADNを作成し,解析を行った.シグナル伝達系路上にあるシグナル分子の特徴解析には,次数,近傍中心性,媒介中心性および,ネットワーク上からシグナル分子を取り除いた際に変化する平均最短経路長と切断点の変化を用いた.構造の特徴解析にはネットワークの密度,平均クラスタリング係数,平均最短経路長を用いた.また,海馬のシグナル伝達系においては,フィードバックループ (以下,FBL) やフィードフォワードループ (以下,FFL) といった制御構造がランダムに頂点が結合しているネットワークより有意に多く,またネットワークの一部分に偏って存在することが知られている (Ma’ayan et al, 2005).そのため,特定ステップ以内に到達することができるループ構造 (kサイクル構造 (Nochomovitz and Li, 2006))の数を用いてネットワークが包含するFBLやFFLを含むループ構造の解析を行った.経路特性の解析は,細胞外のリガンドを入力とし,出力を細胞骨格および転写因子として経路特性の解析を行った.シグナル伝達経路上には,代替経路が多く存在していることが知られている (Coulson, 2006).そのため,経路の解析では経路長や最短経路による解析ではなくk最短経路 (Rahman and Schomburg, 2006)による解析を行った.本モデルにより,海馬シグナル伝達系が遺伝子発現の変化を用いてAD 発症時に起こる頑健性の変化と先行研究で得られたAD 発症時のシグナル伝達の変化を再現した.
ソフトウェアの開発
・開発したソフトウェアについて
本研究生体分子ネットワーク用Pythonネットワーク解析モジュールの開発を行った.プログラミング言語のPythonは可読性に優れ,オープンソースプロジェクトに優れた言語だといわれている.特に,ニューロインフォマティクスの分野でPythonによる解析モジュールの特集号 (Muller and Davison, 2009)が発行されるなど注目をされている.また,生体分子ネットワークのネットワーク解析のソフトウェアに関しても,Cytoscape やNeATなど多くのソフトウェアが開発されるなど注目がされている.本モジュールはPython2.5.2環境下で開発を行った.開発に際しては,Pythonのネットワーク解析モジュールであるNetworkX-0.3,igraph-0.4.5を用いて開発を行っている.また,数値計算に関してはNumpy1.0.4を基盤として開発を行った.本モジュールは: http://web.sfc.keio.ac.jp/~yanasima/BioNetpy.zip
でダウンロードすることができる.
・機能
本モジュールはネットワークの解析のレイヤーをノードの特徴解析,ネットワークの構造的な特徴,経路の特徴解析の三段階に分けている (図2.1).以下,本モジュールが扱うことができるネットワークの形式,ノードの特徴解析,ネットワークの構造的な特徴,経路の特徴解析に関してそれぞれを述べていく.
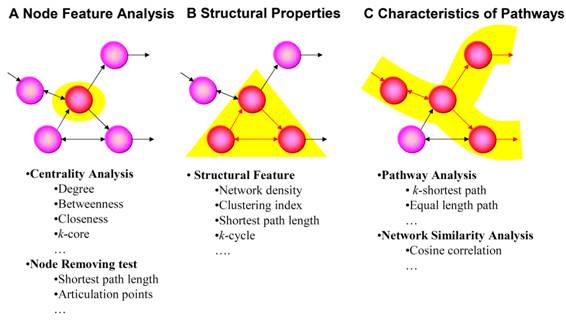
図 2.1. 本モジュールが包含している解析の範囲
本モジュールでは,(A)ノードの特徴解析,(B)ネットワークの特徴解析,(C)経路の特徴解析の三つの範囲の解析ができる.本モジュールは: http://web.sfc.keio.ac.jp/~yanasima/BioNetpy.zip
でダウンロードすることができる.
・扱えるネットワークの形式
ネットワークは頂点(ノード)と枝(エッジ)で構成されている.ネットワークのエッジには方向性を持つエッジと持たないエッジがあり,前者で構成されたネットワークを無向グラフとよび,後者で構成されたネットワークを有向グラフという (図 2.2).本モジュールでは双方のネットワークに対応している.また,データの読み込み形式としては,エッジリストによる読み込みを採用した.
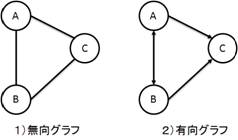
図2.2 本モジュールで扱えるグラフの種類
1)はエッジが方向を持っていない無向グラフ,2)はエッジが方向性を持っている有向グラフ.本モジュールでは双方のグラフを扱うことができる.
また,生体分子ネットワークにおいてはノードやエッジの着脱によって起こる変化を解析する例 (Hahn
and Kern, 2005; Maslov et al., 2009)が多いため、本モジュールにおいても特定の生体分子群を与えることでノックアウト解析を行う機能やランダムノックアウトを行う機能,その他エッジの方向性をランダムにする関数などを搭載している.
・ノードの特徴解析
本モジュールではノードの特徴解析の手法として,中心性として次数,媒介性,近接性,コアネスの4つの特徴量を採用している.次数とは,ある1つのノードに接続しているエッジの数を指している.ネットワーク上にあるノードの次数の分布がベキ乗則に従う性質をスケールフリー性という.生体分子ネットワークにおけるスケールフリーの性質は横断的な生物種で確認されており,次数が高い生体分子が癌などの疾患の原因になっているのではないかといわれている (Ideker and Sharan, 2008).媒介性はネットワーク上での情報伝達においてハブの役割を果たす指標である.ネットワーク上でハブになっているノードが媒介性が高いということになる.媒介性に関しても,有向グラフの場合は入力の媒介性と出力の媒介性に分けて解析を行うことがある.近接性とは,グラフの中のあるノードと他のノードに対する近さに関する指標であり,近接性に関してもノードに対して入力出力で場合を分けて解析を行うことがある.コアネスという指標はあるノードと同じ次数を持つノードで構成されたサブネットワークの大きさを示す指標である.また,上記の特徴量以外にも特定のノードを取り除いたときに変化する最小切断点数の変化や最短経路長の変化などに関する解析を行うことができる.
・ネットワークの構造的な特徴の解析
ネットワークの構造的特徴の解析手法として,ネットワークの密度,クラスタリング係数,平均最短経路長およびk-cycle構造の分析などを行うことができる.ネットワークの密度とは,ネットワーク内のノード同士の関係性を示す指標である.ノード同士を結ぶエッジが密接なものを密度の高いネットワークとよび,ノード同士を結ぶエッジが少ないネットワークを密度の低いネットワークという.式の中のn
はノードの数,m
はエッジの数である.エッジの数が多いほど密度の値が大きくなるのでグラフが複雑になる.
クラスタリング係数は以下の式でネットワークの中でのノードの集まりの度合いを表す指標である.ネットワークのクラスター性を示す指標として用いられる.式中iはあるノードを示しており,あるノードiから接しているki個のノードがすべて互いにエッジが張られていたら,それらのエッジの総数はki(ki−1)/2である.しかし,実際はki個のノードすべてにエッジ数が張られているわけではないので,実際に張られているエッジの数をEiとし,あるノードiのクラスタリング係数Ciを得る.ネットワーク全体のクラスタリング係数を計算する際はネットワーク上の全ノードのクラスタリング係数の平均値を取る
.
平均最短経路長は,各ノードから各ノードへの最短経路長の平均値である.最短経路長を求める手法として,ダイクストラ法やワーシャルフロイド法が知られている
(Ahuja et al., 1990)が本モジュールではダイクストラ法を用いている.この指標は,クラスタリング係数とともにネットワークのスモールワールド性の指標に用いられている.k-cycle構造はkステップで到達できるループ群を表す指標である.生体分子ネットワークでは,FBLやFFLといった制御構造がネットワーク上に多く存在することが知られている.
・経路の特徴解析
経路の特徴解析のために3つの経路群を規定し,解析を行うための手法の開発を行った.一つ目の経路群は同一経路長で到達できる経路群である.擬似的な時間をステップ数として規定すると,ここで得られる同一経路長で到達できる経路群は関連の強い経路群だと考えることができる.そのため,本修士論文では状態の異なる二つのネットワークの情報伝達の状態を比較する指標として設定している
.図2.3の場合,経路長3の経路が1経路,経路長4の経路が2経路ということになる.二つ目の経路群はk最短経路の経路群である.k最短経路とは,特定経路長
(k)以内で到達することができる経路群である.同一経路長の経路群と同様にステップ数を擬似的な反応時間と規定しており,ここで得られるk最短経路の値は反応終了時間までに反応を終了した量,つまり細胞内で起こった特定のイベントの量を示す指標としている.そのため,特定の入力から出力に対応した機能がネットワーク上の他の経路と比較してどの程度の影響力を持つ機能であるかを比較するための指標として用いている.図2.3の場合,k =
2のとき経路数が1経路,k =
3のとき経路数が3経路ということになる.三つ目の経路群は最短経路から特定ステップ(x)長い経路の経路群である.この経路群は上記の二つの経路群とは異なり,時間ではなく特定の入出力に存在する代替経路の状態や迂回路の量を定量化する指標である.本修士論文では,最短経路長で到達できる経路数が最短経路から特定ステップ数で到達できる経路群と比べて大きい場合をシグナルの伝達速度が機能を果たす上で重要な経路だと規定し,小さい場合はシグナルを伝達する際に頑健性が重要になる経路であると規定して解析を行った.図2.3の場合,最短経路の経路数が1経路で,最短経路から1ステップ長い経路群が2経路ということになる.
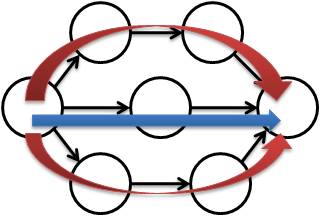
図2.3 経路の特徴解析の解説のための図
上記の図では,経路長4の同一経路数が2経路,k =
3のk最短経路が3経路,最短経路から1ステップの経路数が2経路となる.
解析対象のアルツハイマー型認知症患者のシグナル伝達経路の構築
・遺伝子発現データの解析

図3.1:哺乳類海馬CA1部位のシグナル伝達経路
本ネットワークは570のノードと1,333のエッジを持っている.ノードは,シグナル分子に対応しており,エッジは化学反応に対応している.エッジは,活性化,不活性化,そして活性の特定の値をもたない反応の三つの情報が含まれている.
本研究では,哺乳類海馬CA1部位のシグナル伝達経路を有向グラフで表現したネットワーク (以下,CN)を用いた (Ma’ayan et al, 2005) (図3.1).本ネットワークは570のノードと1,333のエッジを持っている.ノードは,シグナル分子に対応しており,エッジは化学反応に対応している.エッジは,活性化,不活性化,そして活性の特定の値をもたない反応の三つの情報が含まれている.Homo sapiens の海馬CA1部位における遺伝子発現をAffymetrix
GeneChip Human Genome U133 Plus 2.0 Array (HGU-133)によって測定したGeneChipのデータをBioconductor
のaffy packageにより抽出を行った.本データには晩期発症型のAD患者
(N = 10)と健常者 (N = 13)の遺伝子発現データ (Liang et al., 2007)が含まれており,これらを解析することでAD関連遺伝子を抽出した.
Affymetrix法で得られたデータの正規化手法には,Microarray Analysis Suit (以下,MAS),Robust Multichip Average (以下,RMA),RMAにプローブのシグナル強度をGC含量の関数としてモデル化したGCRMA やPerfect matching (以下,PM)値やmiss matching (以下,MM)値の補正や正規化を行う,Factor Analysis for Robust Array Summarization (以下,FARMS)法,Distribution Free Weighted (以下,DFW)法などが知られている.本研究では,遺伝子発現データの正規化手法はDFW法を用いた.本手法は,プローブの信号強度を底を2とする対数変換して,Probe Weightsという重み付け関数を用いて正規化を行う.すべてのPMプローブから信号強度の中央値Mを計算し,それぞれのPMプローブの信号強度の差をx,Jをプローブセットの総量としてProbe Weightsは得られる.
プローブのProbe Weightsの範囲をWRとして,Probe Weightsの標準偏差をWSDとして,2つ以上の試料で発現量が異なっている遺伝子と異なっていない遺伝子と分けて最大値から最小値までの遷移範囲で各Probe Weightsを正規化したTIVとして発現量を求める.intは信号強度である.
本手法は,他の正規化の手法と比べ正規化を行う際に使用するメモリの容量が少なく,また,spike-inコントロールを行ったHuman Genome U95チップ (以下,HGU-95)とHuman Genome U133チップ (以下,HGU-133)を用いたベンチマークテストにおいて他の手法と比べて高い精度で判別を行うことができるという結果が得られているため,本手法を用いた.
正規化を行った後のAD関連遺伝子の抽出方法としては,limma packageの経験ベイズによるベイズt検定を用いて得られた結果の中から,閾値p < 0.005の遺伝子をAD関連遺伝子とした.遺伝子と遺伝子がコードしているシグナル分子をNCBI Gene IDとSwiss-Prot
IDを用いて対応付けを行い,AD関連遺伝子によってコードされているシグナル分子をAD関連シグナル分子とした.ここで得られたAD関連シグナル分子の次数と媒介中心性,近傍中心性およびノードをネットワーク上から取り除いたときの平均最短経路長の変化,切断点の変化を用い,それらのネットワーク上での特徴解析を行った.
・ネットワークに内在するループ構造の解析
ネットワークに内在するループ構造の解析には,kサイクル構造による解析を用いた.kサイクル構造は,あるノードからひとつ前のノードにkステップで到達できるサイクル構造の中から重複しているものを取り除いたものをネットワーク構造が包含しているkサイクル構造とした.先行研究で経路の入力から9ステップ以内に到達する点がネットワーク上にあるエッジの9割であることが知られているため (Ma’ayan et al, 2005),9 ステップまでに到達する経路を信号伝達に寄与しているとして解析を行った.また,ネットワーク構造はノード数に依存するため,ADNのノード数と同数になるようにCNからノードをランダムで除去し,ADNと比べてネットワークの密度,平均クラスタリング係数,平均最短経路長の値の変化量を0.05に制御することでランダムネットワーク (以下,RN)を作成し,比較を行った.
・AD患者の海馬シグナル伝達経路の経路特性
シグナル伝達経路上に存在している構造は,代替経路が多く存在していることが知られている .そのため,本研究では経路特性の解析として経路長や最短経路ではなく特定ステップで到達できる経路 (k最短経路)により解析を行った.また,kサイクル構造と同様にRNを生成して比較をすることで解釈を行った.k最短経路の探索は事前にあるノードからノードまでの最短経路を学習させた後に反復深化アルゴリズムを用いて特定ステップまでに含まれている経路を探索し,経路数を数え上げた.k最短経路の入力を細胞外のリガンド (30種),出力を細胞骨格 (24種),転写因子 (35種)
として1,770経路を規定して経路数を用いて解析を行った.本研究における経路の頑健性はネットワークの規模に対して経路数を経路の頑健性と定義した.経路の頑健性の評価は全入出力の中におけるそれぞれの経路のZ-scoreをCNおよびRNと比較し,行った.また,特に神経細胞内の主要機能である神経可塑性,突起進展の二つの機能に関連した入出力を注目することでADが神経細胞の主要機能に与える影響の解析を行った.神経可塑性の機能は,glutamate がシナプス後細胞の受容体に結合することで,Ca2+イオンが流入して脱分極を引き起こす機能を指す.それに続いて,色々なタンパク質が活性化・不活性化することでcAMP response
element-binding protein (creb) の活性化させ,amino-3-hydroxy-5-methyl-4-isoxazolepropionic
acid receptor (AMPER) の量を増やす.このことから,経路の始点をglutamate,終点をcreb
に設定した.突起伸展は,ガイダンス因子によって伸長方向を決定する構造である.経路の始点は,Acetylcholine (ACh),Insulin-like
growth factor I (IGF1),nerve
growth factor (NGF),Ephrin
などのガイダンス因子とし,終点を微小管タンパク質であるtubulin
に設定した.また,細胞外のリガンドから転写因子または細胞骨格因子にいたる経路以外でも神経細胞死に関する経路およびAPPに直接作用を行っている経路を規定し,解析を行った.神経細胞死は,細胞外のデスリガンドや細胞のDNA 損傷などのシグナルを受け取ると細胞が速やかに死に向かう現象を指し,神経回路網の形成の原理を理解する目的で広く研究されている.経路の始点はアポトーシスを誘発するFas ligand (FasL) とtumor necrosis
factor-α (TNFα)し,終点をDNA の断片化を行うインヒビターであるDNA fragmentation
factor subunit alpha (ICAD) に設定した.また,APPに関連する経路として全リガンドからAmyloid beta A4 precursor protein-binding family A member 1
(MINT-1)とcaspase-3に至る経路を設定した.これらの経路は入力から出力に至る経路よりも短く到達することができるため,これらの経路の数を全経路数で割ったものとRNで得られた経路の数を全経路数で割ったものとを比較することで蓄積または到達の比較を行った.これらの経路の k最短経路解析のステップ数kはkサイクル構造で用いたステップ数と同様に9ステップとした.
ここのRは経路の頑健性をあらわすスコア (以下,R-value)である.神経可塑性の経路および,突起伸展を規定している入出力においては,Rは全入力から全出力にいたる経路のk最短経路の平均値と標準偏差を用いて正規化を行った.神経細胞死およびAβの蓄積に関連している経路では,Rの値にADとCNにおける各出入力のセットのk最短経路数とRNNにおける同じ入出力からの経路数の平均値と標準偏差で正規化した値を用いた.
また,ネットワークの入出力の同一経路長 (e)で到達できる経路の経路数を行列表現し,ベクトル空間上での特異値分解を用いてネットワークの類似度の解釈をコサイン尺度を用いて行った.
ここにおけるSはネットワーク間の類似度である.ceは経路長eで到達できる経路数を要素とした行列での特徴ベクトルで,oeはCNと比較するADNまたはRRNにおいて経路長eで到達できる経路の集合の特徴ベクトルを示している.
・シグナル分子の特徴解析の結果
経験ベイズによるベイズt検定を行った結果,76個のADに関連した遺伝子が得られた.この中には,ADを発症することで減少することが知られているactinやβcatenin,actinが減少することで減少することが知られているCalcium/calmodulin-dependent protein kinase type II alpha chain
(CaMKII)が減少することがわかった.これらの遺伝子に対応したシグナル分子をCNから取り除いて,ADNを作成したところ以下の表3.2の結果が得られた.
表3.2構築されたネットワークの構成要素
OtherにはHistoneやその他の小分子などが含まれている.ReceptorやBcl2Familyの機能を果たしているシグナル分子のグループがもっとも減少することがわかり,全体では13%のシグナル分子が減少するということがわかった.
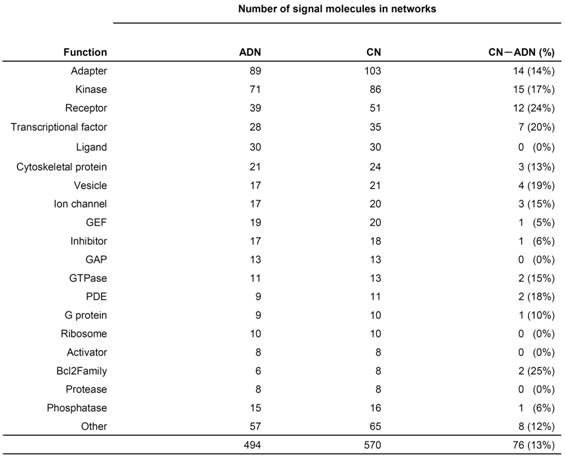
酵素や受容体の機能をしているシグナル分子がもっとも減少する数が多い事がわかった.一方,割合に関してはレセプターやBcl2Familyの機能を果たしているシグナル分子のグループがもっとも減少することがわかり,全体では13%のシグナル分子が減少するということがわかった.次に各ノードに関してコアネス,媒介性,近傍性,次数の解析および各ノードの最小切断点および最短経路の分析し,ADに関連したシグナル分子とそのほかシグナル分子の間で比較を行った(p<0.05,Mann-Whitney U test).
ここで比較をおこなったすべての中心性の指標に関してAD関連シグナル分子とそれ以外のシグナル分子で有意な差を見ることができなかった.また,シグナル分子を除去した際に起こる変化に関しても両者の間に有意な差は得られなかった.
ここで得られたADに関連したシグナル分子をCNから取り除いてネットワークを構築した結果,494ノードで974エッジからなるADNが作成された.また,CNが入力から出力まで91%の組み合わせで到達することができ,平均最短経路長が5.94ステップになったのに対して,ここで作成したADNでは入力から出力に対して,50%の組み合わせでしか到達することができなくなり,平均最短経路長が6,68ステップに増加した.
・AD患者のシグナル伝達経路の構造的な特徴
kサイクル構造の解析には,AD関連シグナル分子のセットがネットワークの密度,平均クラスタリング係数および平均最短経路長の3指標の変化の割合が5%以内に抑えたランダムのAD関連シグナル分子のセットを元にRNを作成して比較を行った.RNおよびCNとADNが包含するkサイクル構造の数 (k=4,….,9)を比較したところ,すべてのステップkにおいて減少することが示された (図3.2).しかし,各RNと比較して各ステップ数に対するサイクル構造数のグラフの形状が類似しており,特定の外部要因によってネットワークのサイクル構造の数が変化しているのではなくネットワークの規模がネットワーク全体のサイクル構造に対して影響を与えるということが示された.
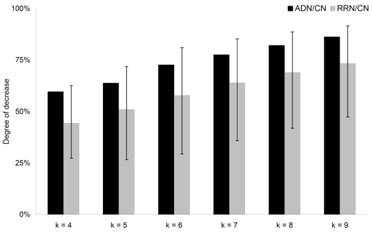
図3.2:CNと比較した際のネットワーク内にあるkサイクル構造の割合
すべてのステップkにおいて減少するが各RNと比較して各ステップ数に対するサイクル構造数のグラフの形状が類似しており,特定の外部要因によってネットワークのサイクル構造の数が変化しているのではなくネットワークの規模がネットワーク全体のサイクル構造に対して影響を与えるということが示された.
・アルツハイマー患者のシグナル伝達経路の経路特性の解析
k最短経路解析 (k=9)の結果におけるネットワークの経路数の平均値に関してADN (67±216)とRN
(144±342)の間に差異を見ることができなかった.このことから,AD関連シグナル分子およびランダムに同数のシグナル分子を抽出したセットは全入出力の組み合わせに対して特定の影響を与えるものではないということが判明した.次に,全入出力の組み合わせの中から神経可塑性,突起進展に対応した経路および神経細胞死とAPPの蓄積に対応した経路の頑健性の変化の解析 (k=4,…,9)を行った
(図3.3).各kにおいてADN-CNとADN-RNの双方において神経可塑性に対応した経路の頑健性の変化が最も大きいということが判明した.同様に突起進展の中でも神経細胞の維持作用を持つNGF (Tuszynski et al.,
2005)と,Aβの蓄積により減少するACh (Hoshi et al., 1997)に関連した経路で頑健性の減少量が大きかった.ここで得られた神経可塑性,NGF,AChの頑健性は減少量上位10%に含まれていた.また,全組み合わせの中で最も大きく頑健性が変化した組み合わせはglutamateからactinに至る経路 (ADN-CN=−14.9,
ADN-RN=-13.6, RN-CN=-1.29)であった.ADNとRNを比較した解析に関してもCNと比較した際と同様の変化が得られたため,ここで得られた変化はシグナル分子数や密度,平均クラスタリング係数,平均最短経路長といった指標に依存した変化ではないことが示された.神経細胞死に関する解析では,FasLからICADに至る経路には変化が見られなかったのに対して,Aβの増加に対して相関があることが知られている (McCusker et al., 2001)
TNFαからICADに至る経路に関してはR-valueが大きく変化した。また,APPに関連した経路に関してもMINT-1は変化をしなかったがAβの量と正の相関があることが知られているcaspase3 (Cacquevel et al.,
2004)に関しては増加しており,Aβの蓄積が表現されたと考えられる.また,RNとCNを比較した解析では,頑健性が大きく変化をした組み合わせがなかったことから神経可塑性や突起伸展といった機能はランダムに与えられる影響に対して頑健であり,AD関連シグナル分子はランダムに選択したシグナル分子と比べて,神経可塑性や一部の突起伸展の入出力に対して選択的に影響を与えているという結果が得られた.
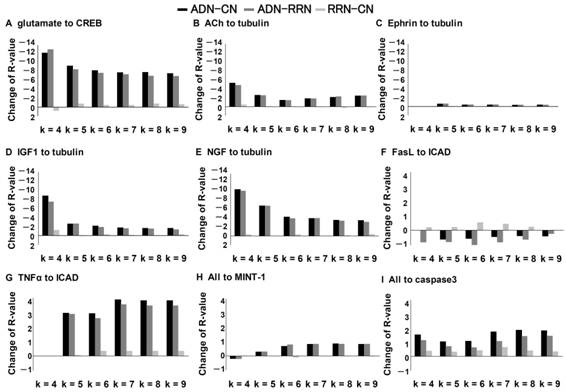
図3.3:各シグナル伝達経路の頑健性の解析結果
(A)神経可塑性に関する経路(glutamateからcrebにいたる経路).(B)〜(E)は神経細胞の突起の伸展にかかわる経路(ACh,Ephrin,IGF1,NGFからtubulinにいたる経路).(F),(G)神経細胞死に関する経路(FasL,TNFαからICADにいたる経路).(H)(I)Aβの蓄積に関連した経路(MINT-1,caspase3にいたる経路).
入力から全出力に対する解析では,βsecretaceの基質であるNeureglin
(NRG) (Willem et al., 2006)やADの創薬のターゲットとなっているNGF,近年ADとの関連性が研究されているreelin (Botella-Lopez et al.,
2006)や神経伝達物質であるdopamineといったシグナル分子が減少量の上位に現れた (図3.5).また,増加した群にはEpidermal
growth factor (EGF)やニューロトロフィンファミリーであるBrain-derived neurotrophic factor (BDNF)やNeurotrophin
4 (NT4)が表れた.BDNFはin vivoの研究において,AD患者やマウスの海馬において上昇することが知られている(Laske et al., 2006; Tang
et al., 2000).しかし,Z-scoreの範囲がすべての入力において0.8から−1.2までに含まれていることからADが入力に対して与える頑健性の影響は小さいということが示唆された.全入力から出力にいたる経路では,減少した群には神経可塑性や突起伸展を規定する細胞骨格因子であるactinやtubulin,転写因子のcrebといった神経活動における重要因子が得られた (図3.5).また,上昇した群には細胞骨格因子ではα-actininやprofilinといったactin結合タンパク質が上位に見られ,転写因子ではNuclear factor of activated T cells c1 (NFAT)が上位に現れていた.入力から全出力にいたる解析と比較してZ-scoreの範囲が1.2から−4.1であったため,ADは入力と出力を比較した際に出力に対してより大きな影響を与えるということが示された.
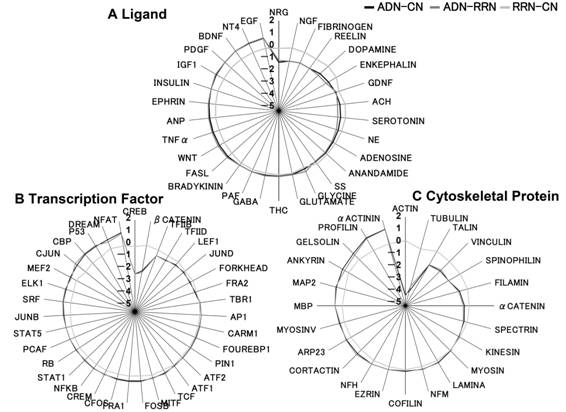
図3.4: 特定の入力から全出力へのR-valueの値(A)および全入力から各出力へのR-value
(A)βsecretaceの基質であるNRGやADの創薬のターゲットとなっているNGF,近年ADとの関連性が研究されているreelinや神経伝達物質であるdopamineといったシグナル分子が減少量の上位に現れた.また,増加した群にはEGFやニューロトロフィンファミリーであるBDNFやNT4が表れた.(B)(C)減少量の上位に神経可塑性や突起伸展を規定する細胞骨格因子であるactinやtubulin,転写因子のcrebといった神経活動における重要因子が得られた.上昇した群には細胞骨格因子ではα-actininやprofilinといったactin結合タンパク質が上位に見られ,転写因子ではNFATが上位に現れていた.
次に,入力と出力の組み合わせを行列表現することでCNとADN,RNの双方の類似度変化の解析を行った結果,k=5,9においてはRN と比べADNが低い値を示し,k=6,7,8ではRNと比較してADNは高い値を示すということが判明した (図3.5).また,各ステップに対する双方の標準偏差を見てみたところ,ADN=±19°,RN=±2°と系全体に関してもランダムの影響に対して頑健であることがわかり,AD関連シグナル分子が系に与える影響はステップごとに変化することが示された.
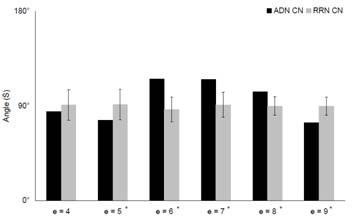
図3.5:CN,ADN,RNのネットワークの類似度の解析結果
横軸は指定した経路長(e).縦軸はコサイン類似度を表す角度.
各ステップに対する双方の標準偏差を見てみたところ,ADN=±19°,RN=±2°と系全体に関してもランダムの影響に対して頑健であることがわかり,AD関連シグナル分子が系に与える影響はステップごとに変化することが示された.
研究成果
本研究の成果として,本年度は以下の論文発表、学会発表および口頭発表を行った.
国際論文誌
・R. Yanashima,et al.
(2009) “Network Features and Pathway Analyses of a Signal
Transduction Cascade” Front Neuroinform., 13, 1-10.
口頭発表
・簗島亮次、小出幸典 (2010) Recomedia オペレーションズリサーチ学会実践データマイニング研究部会
ポスター発表
・簗島亮次, 菊地進一、石崎俊 (2009) 哺乳類海馬CA1部位シグナル伝達経路における主経路抽出法.日本神経回路学会大会
おわりに
これらの研究は,2009年度森基金の助成を受けて行われた研究である.