2010年度森基金成果報告書
好酸好熱性古細菌サーモプラズマにおける
新規RNAエレメントの探索と検証
政策メディア研究科 修士課程2年
先端生命科学プログラム
豊島裕美
学籍番号:80925022
要旨
蛋白質に翻訳されずに機能しているRNAエレメントは遺伝子発現の様々な段階に関わっている.例えば,mRNAの非翻訳領域に存在する高次構造であるリボスイッチは,リガンドが結合することによって構造を変化させ,転写や翻訳の終結または自己切断などを行うことが知られている.このリボスイッチはバクテリアにおいて広く分布しており,また真核生物においてもスプライシングの制御を行う例が報告されている.しかしアーキア(古細菌)ではサーモプラズマ目にTPP結合型リボスイッチが予測されているのみであり,未だに実験的な検証はされていない.
RNAエレメントの多くは進化的に配列と構造が保存されており,比較ゲノムの手法は新規のRNAエレメントを予測する上で効果的な手法である.本研究では,リボスイッチをはじめとするアーキアにおける新規のRNAエレメントの同定を目指し,好熱好酸性アーキアThermoplasma volcaniumを対象として,近縁4種間で進化的にRNA二次構造が保存されている領域を抽出し,52の新規RNAエレメント候補を予測した.10候補を実験による検証対象に選び,そのうちの8候補についてRT-PCRおよび増幅産物のシークエンシングを行ったところ,全てRNAとして発現していることが確認された.さらに新規RNAエレメント候補とともに抽出されたTPPリボスイッチ補のTPPへの結合性をゲルシフトアッセイにより確認することができた.
背景
古細菌とは,1977年にウーズらが行った,リボソーム小サブユニットRNA(SSU-rRNA)の配列を用いた系統分類により報告された生物群である.古細菌は高温,強酸,高塩などの極限環境から数多く発見されている.例えば強酸性の温泉や炭坑から単離されたThermoplasmaは至適温度が60℃,pH 1〜2という高温・強酸環境下で生育する.古細菌は核を持たない原核生物であるが,その性質は同じ原核生物であるバクテリアとは大きく異なる.特に転写・翻訳機構は真核生物に近いことが知られている.一方代謝経路についてはバクテリアに近いとされる.そのため古細菌における遺伝子発現の制御機構を知る事は非常に重要であると考えられる.
近年の研究の進展により,遺伝子発現の制御には遺伝子をコードしない機能性非翻訳型RNAが重大な役割を果たしていることが判明している.このような機能性非翻訳型RNAを本研究ではRNAエレメントと称している.RNAエレメントの一種にリボスイッチというmRNAに存在する高次構造がある.リボスイッチはmRNAの非翻訳領域に存在しており,特異的な代謝物質が結合することで形状を変化させ遺伝子発現の制御を行う.バクテリアでは基本的に代謝系の遺伝子の発現制御を行っており,真核生物ではスプライシングの制御を行う例が報告されている.その一方古細菌においてはThiamine Pyrophosphate(TPP)結合型リボスイッチがThermoplasmaなどの一部の種において配列レベルで予測されているものの,実験的な検証は未だされていない.
このように古細菌におけるRNAエレメントについての知見は,真核生物やバクテリアに比べて少ないのが現状である.遺伝子の発現制御機構を知るためにも,まずは古細菌における新規のRNAエレメントを同定することが重要であると考え,本研究では好熱好酸性古細菌T. volcaniumを対象にリボスイッチを始めとする新規RNAエレメントを比較ゲノムで予測し,実験的な検証を行った.
新規RNAエレメント候補の予測
T. volcaniumを中心とした近縁4種間で進化的に保存されたRNAの二次構造を抽出,さらに絞り込むことで新規RNAエレメント候補を予測した.進化的に保存されたRNA二次構造をとる領域は108領域であった.これはT. volcanium全ゲノムの0.7%,11,491bpに相当する.そのうち56領域に既知のRNAエレメントの75%が含まれており,機能を持つRNAを効果的に濃縮できたと言える.既知RNAエレメントにはtRNAやrRNA,そしてサーモプラズマ目で予測されている2つのTPPリボスイッチが含まれていた.既知RNAエレメントを含む領域を除いた残りの52領域を新規RNAエレメントとしてさらなる解析を行い,その中から8領域を2つのTPPリボスイッチ候補と共に実験対象に選んだ(表1).
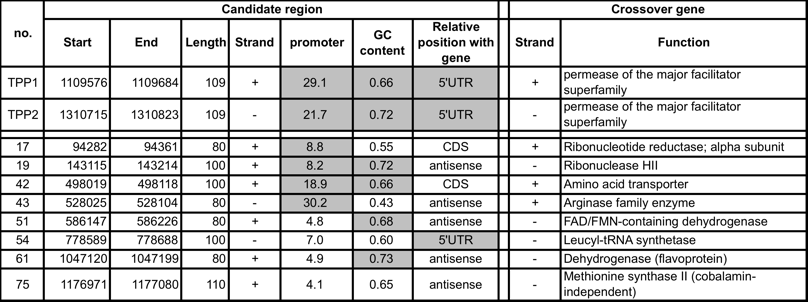
表1. 実験対象に選んだ新規RNAエレメント候補
新規RNAエレメント候補の発現確認
遺伝子の5’UTRもしくはアンチセンスに存在する候補については,RT-PCRとシークエンシングでRNAとして発現しているかを確かめた.RT-PCRには理研より提供されたT. volcanium GSS1株を培養して抽出した全RNAを用いた.若干の非特異的なバンドも見受けられたものの,逆転写酵素依存的に特異的な増幅が起きていた(図1).さらにこのバンドを切り出し生成を行った産物をシークエンシングしたところ候補配列と同一であった.以上より,候補配列がT. volcanium細胞内でRNAとして発現していることが確認された.
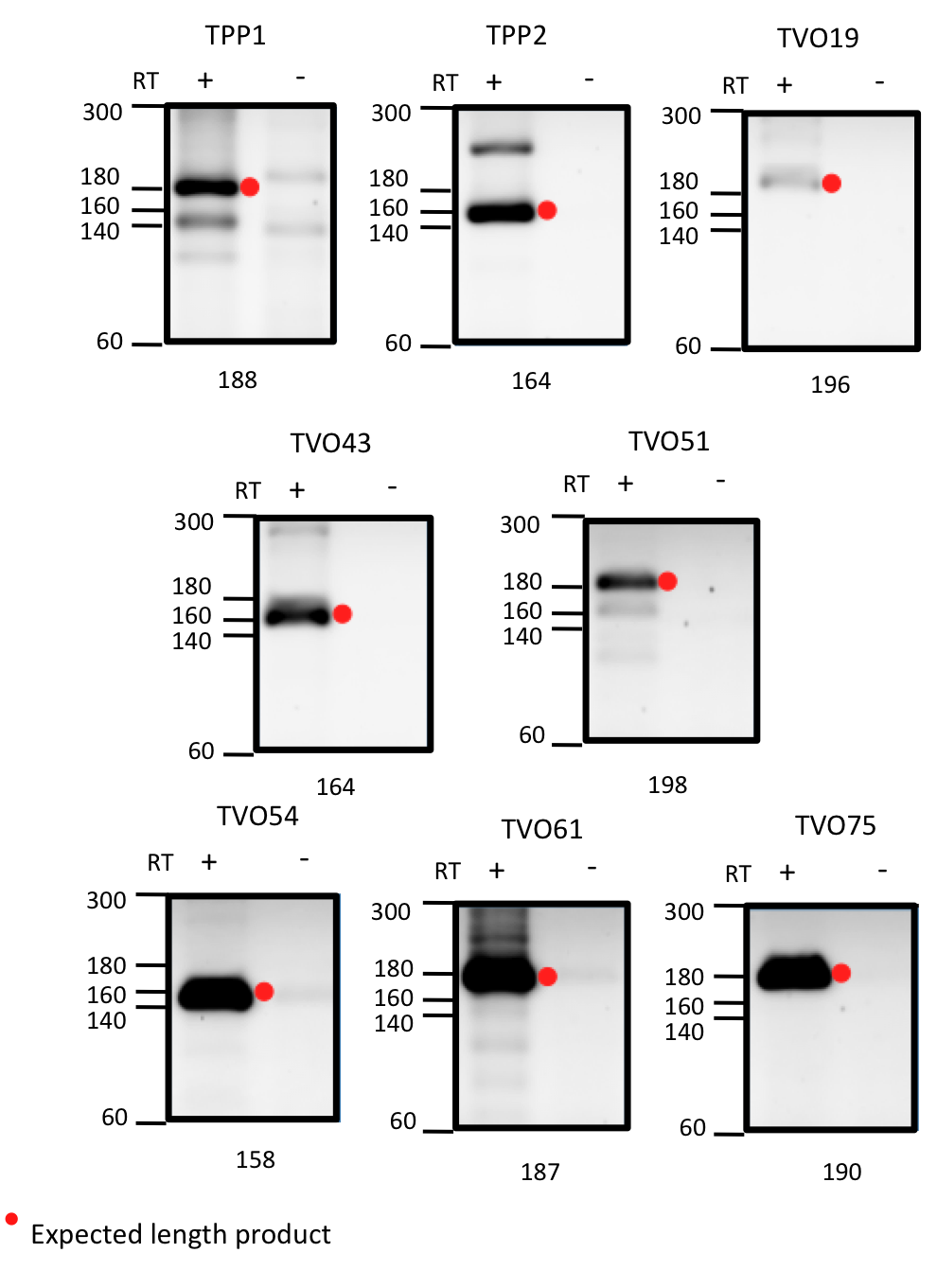
図1. RT-PCRによる発現確認
TPP結合型リボスイッチ候補の機能検証
T. volcaniumで予測されているTPPリボスイッチ候補(図2A)の機能の検証をゲルシフトアッセイによって行った.ポジティブコントロールとしてすでに実験的に機能と構造が確認されているEscherichia coliのリボスイッチ配列(図2B)を用いた.その結果,E.coliのリボスイッチと同様に,T. volcaniumのTPPリボスイッチ候補でもTPPを加えた場合にバンドがシフトしていることが確認された(図2C).また,リボフラビンやThiamine,Thiamine disulfideなどを加えた条件でも同実験を行った場合にはシフトは見られず,TPPリボスイッチ候補がTPP特異的に結合していることが分かった(データは不掲載).
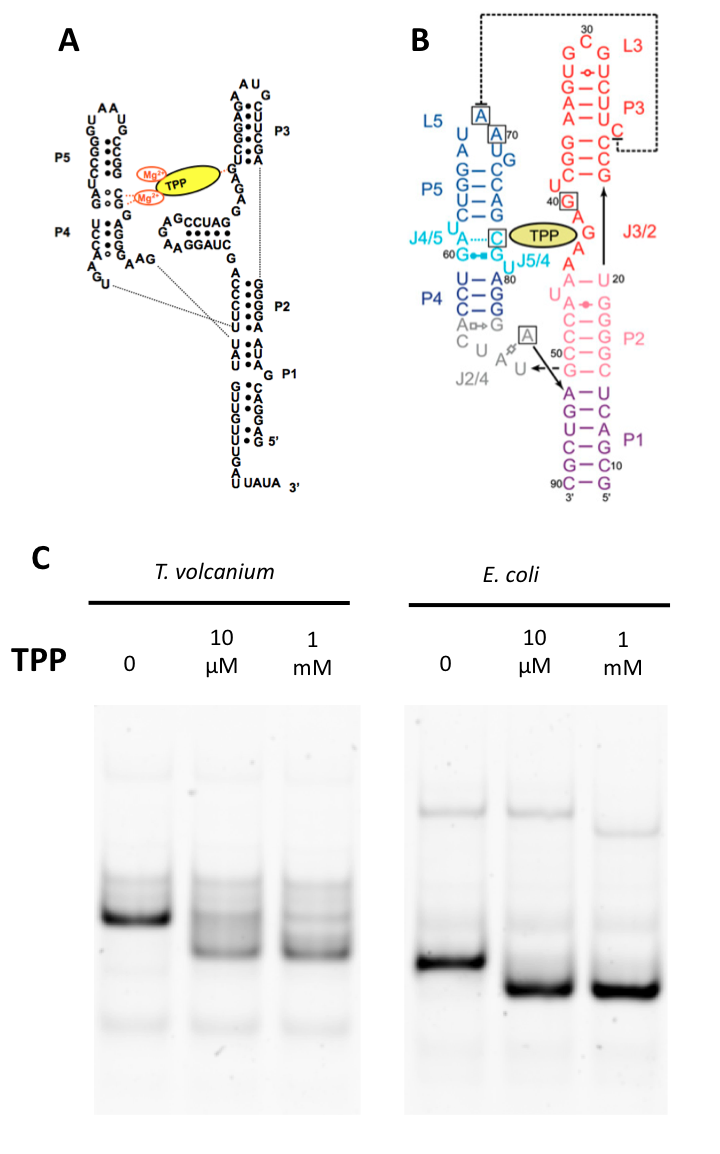
図2. TPPリボスイッチ候補のゲルシフトアッセイ
新規候補の機能検証
表1に記載したTVO42とTVO43についても,TPP結合型リボスイッチと同様にゲルシフトアッセイで代謝物と候補が結合するのかを検証した.しかし,ゲルシフトアッセイではポジティブな結果は得られなかった.結合するリガンドが別の物質である可能性,またリボスイッチの様に特定の代謝物と結合するのではなく別の働き方をする可能性がある.
結論
比較ゲノム的手法を用いてT. volcaniumにおける新規RNAエレメントの候補を抽出した.新規候補とともにTPPリボスイッチ候補として予測されている配列も抽出されており,ゲルシフトアッセイによって機能を検証したところTPP特異的に結合することが確認された.古細菌のリボスイッチが実験的に検証された例は報告されておらず,本研究が世界初の例となる.新規候補については本報告書までの研究では機能を確定することができなかった.しかし,RNAとして細胞内で発現していることと,新規RNAエレメント候補とともに既知のRNAエレメントが抽出できていることから,何らかの機能を持つ可能性が高いと考えている.
学会発表
Hiromi Toyoshima, Kosuke Fujishima, Masaru Tomita , Akio Kanai, (2010) 好熱好酸性アーキアThermoplasma volcaniumにおける比較ゲノム的手法を用いた新規RNAエレメントの予測と実験による検証, BMB2010, Kobe, Japan.
©Hiromi Toyoshima All Rights Reserved Mail:merry@sfc.keio.ac.jp