がん細胞の酸化ストレス適応能力への代謝の寄与を探る
政策・メディア研究科・修士課程 1 年 飯野慧子
要旨
活性酸素(ROS)は,DNAやタンパク質,脂質と容易に反応し酸化傷害を起こす.紫外線やエネルギー代謝によってROSは常に生成されており,細胞は過度の酸化傷害を防ぐため複数の抗酸化機構を発達させている.代謝は抗酸化作用を担うシステムの一つであるが,その酸変動がどのように機能し抗酸化的に働くのか明確には分かっていない.本研究では過酸化水素(H2O2)を負荷した膵臓がん細胞(Panc-1)において,還元型グルタチオン(GSH)およびペントースリン酸回路(PPP)とTCA回路上の代謝物が一時的な増減を示すことを確認した.それぞれの経路とPanc-1のH2O2感受性の関係を調べるため,代謝経路を阻害してH2O2暴露したところ,グルタチオン合成経路を阻害した時のみH2O2感受性が高まることが分かった.グルタチオン合成を阻害しH2O2暴露した場合,阻害しなかった細胞に比べGSH量が減少したが, PPPとTCA回路上の代謝変動には違いは見られなかった.また,H2O2暴露した結腸がん細胞(Caco-2)の遺伝子発現解析を行ったところ,グルタチオン合成経路と酸化還元経路がH2O2暴露30分以降に活性化されていることが予測された.以上の結果より細胞のH2O2暴露への適応には,グルタチオン合成代謝が必要であり,一方でエネルギー代謝経路上物質の変動はH2O2暴露に対する耐性への影響は低いことが示唆された.酸化ストレスに対する代謝変動はROS除去や酸化傷害部の補修作用を支えていると考えられ,代謝機能の解明が細胞の抗酸化機能を理解する上で重要である.
キーワード
過酸化水素,酸化ストレス,代謝,グルタチオン
1.
序論
細胞内では活性化された酸素またはその関連物質(活性酸素種(ROS))が常に発生している.過剰量のROSは細胞内のDNAやたんぱく質を損傷する酸化ストレスとなり,疾患や細胞死を誘引する.がん細胞は,通常より強い酸化ストレス環境下で生存していることが報告されており1-3,この適応機構は,放射線や抗がん剤に対する耐性獲得の原因の一つである.そのため,がんの酸化ストレス耐性獲得機序の解明はがん治療の発展における重要課題とされる4,5.
代謝調節による酸化ストレス耐性は,特に環境依存的な酸化ストレス防御システムにおいて重要な働きをしていると考えられている6.代謝物には,酸化ストレス分子と反応し無毒化する物質が複数存在し,例えばポリフェノールやカテキンなどがその例といえる.さらに,ROSによる細胞内機能の損傷を補うための代謝調節も考えられ,それらに関わる代謝が酸化ストレスマーカーや治療標的になる可能性がある.
これまで細胞内代謝物の研究は技術的に困難であった.しかし申請者の所属する慶應義塾大学先端生命科学研究所が開発したCE-TOFMSは,網羅的代謝物の測定を実現し,代謝研究多くの成果を挙げている6.本研究では,CE-TOFMSを用い網羅的に酸化ストレス耐性獲得の代謝変動データを取得し,代謝物とH2O2耐性との関連の探索を目的とした.さらに,酸化ストレス負荷時の遺伝子発現量の変動データとの統合解析も試み,これによりがん細胞が酸化ストレス耐性を獲得する機構の全容の理解を目指した.
2. 対象と手法
2.1. 細胞培養
human pancreatic
carcinoma cell line(Panc-1)はAmerican Type Culture Collection(ATCC;Tokyo,Japan)から購入し,Dulbecco’s modified Eagle’s medium(DMEM;Sigma-Aldrich;St. Louis,MO,USA)を用いて5%CO2,37°Cの条件下で培養した.H2O2負荷実験では,培地の10%量でH2O2を添加した.
2.2. 代謝物質の抽出
培養液除去後,細胞を5%マンニトール溶液で2回洗浄し,25 μMの濃度補正標準物質(IS;L-methionine
sulfone,2-morpholinoethanesulfonic
acid,D-camphor-10-sulfonic
acid)を含むメタノール(600 μL)を添加して代謝物を抽出した.次に細胞-メタノール混合液とMilli-Q水,CHCl3を2:1:2の割合で混合し,20,000 × gで15分間遠心した.上清を5-kDa cutoff filterに移し9,000 × gで3時間遠心したのち,遠心濃縮器にて抽出液を乾燥固定した.抽出した代謝物質は200 μMの時間補正IS(3-aminopyrolidine,trimesate)を含むMilli-Q水を加えて溶かしCE-TOFMSに処した.
2.3. メタボロームデータ解析
CE-TOFMSの測定条件は他論文で発表されている設定に準じた7.CE-TOFMS測定で得られたデータはMasterHands
ver2を用いてピーク同定を行った.同定した物質のサンプル内物質量は,内部標準を用いて計算し,さらにその値を各サンプリングポイントにおける生存細胞数で割ることで一細胞当たりの代謝物質量を算出した.
2.4. 遺伝子発現解析
遺伝子発現解析では,NBCI
Gene Expression Omnibus(GEO)よりヒト結腸がん由来のCaco-2細胞の時系列マイクロアレイデータを取得した.データは20
μMのH2O2を負荷したCaco-2細胞から,各タイムポイント(0.08,0.25,0.5,1,2,4,8,16,24時間)でRNAを抽出しG4110B
× 22KまたはG4112F4
× 44KのAgilent
Human Oligo Microarrayを用いて得られたデータである8.H2O2暴露群/対象群の値をlog2変換した発現データを用い,4試行全ての値が0.3以上または-0.3以下になる遺伝子のみ選択し平均値を出した.4時間時点のデータは2試行分のデータしかなく解析から除いた.全てのタイムポイントにおいて対象群と差の見られない遺伝子を除き,さらに代謝調節に関わる遺伝子のみをKEGG
ontologyをもとに選択した.クラスター解析を行った結果にエンリッチメント解析を行いクラスター内で有意な代謝経路を調べた.クラスター解析にはMeV
4.6.29を利用し,エンリッチメント解析にはKOBAS
2.010を利用した.
2.5. 物質の抗酸化能測定
フナコシ過酸化水素測定キットを用いて代謝物の還元能を測定した.具体的には30 μMのH2O2溶液に対象代謝物溶液を混ぜ,37℃条件下で30分置いた水溶液中の過酸化水素濃度を測定した.
3. 結果
3.1. H2O2暴露により起こる代謝変動
H2O2負荷後のPanc-1細胞における代謝変動データを解析した結果,H2O2除去作用を持つ還元型グルタチオン(GSH)は30分までに大きく減少し,その後回復傾向を示した(図1A).同様にH2O2暴露直後に大きく変動した物質は,PPP,TCA回路上の物質だった.PPP上の物質は全ての物質量が上昇し,PPPの一時的な代謝促進が示唆された(図1B).一方,TCA回路上の物質については経路上流のcitrateとcis-acconitateの物質量のみ上昇し,経路下流のisocitrate,2-oxoglutarate,fumarate,marateの物質量は変わらないか減少した(図1B).
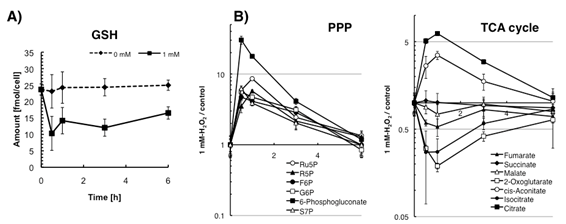
図1.
H2O2負荷による細胞内代謝物量の変化 (A)GSH物質量変化.(B)PPPとTCA回路上の物質量変化.それぞれのタイムポイントにおけるH2O2暴露群と対照群の比を示した.メタボロームデータはH2O2を負荷する直前を0時間とし,最終濃度1
mMになるようH2O2を培地に添加し各タイムポイントで代謝物を抽出した.エラーバーは試行数3回の標準偏差を表す.
3.2. 代謝経路の阻害によるH2O2感受性の変化と細胞内代謝物量への影響
GSH,PPP,TCA回路上の代謝変動は,Panc-1細胞がH2O2暴露に対し生存する上で必要な機能を果たしていると考えられる.グルタチオン合成経路,PPP,TCA回路のH2O2感受性への関与を調べるため,H2O2に暴露するPanc-1細胞のそれぞれの代謝経路を阻害した.PPP阻害剤2-deoxyglucose(2DG)またはTCA回路阻害剤RotenoneそれぞれとH2O2を共添加したところ,両経路の経路阻害によるH2O2感受性の上昇は見られなかった(図2A).一方,グルタチオン合成阻害剤Buthionine
sulphoximine(BSO)とH2O2を共添加したところ,Panc-1細胞の生存率はほぼ0になり,グルタチオン合成経路がH2O2感受性に強く関係していることが示唆された(図2A).グルタチオンはγ-グルタミルシステイン合成酵素とグルタチオン合成酵素の働きで合成されるが,同一酵素で2ABを基質としてophthalmateが生成される(図2B).図2Cにはグルタチオン合成経路に関与するophthalmate,γ-Glu-Cys,GSHの物質量を示した.BSOを処理した細胞ではophthalmateとγ-Glu-Cyが減少し,BSOがγ-グルタミルシステイン合成酵素の活性を阻害している事が確認された(図2C).
H2O2のみを添加した細胞に比べ,H2O2とBSOを共添加した際のGSHおよびγ-Glu-Cysが低い結果から,H2O2暴露後のGSH濃度維持へのグルタチオン合成経路の寄与が示唆された.また,このときのPPP,TCA回路上の物質については,グルタチオン合成阻害の有無に関わらずH2O2暴露に対し同じ代謝変動を示した(図S1).
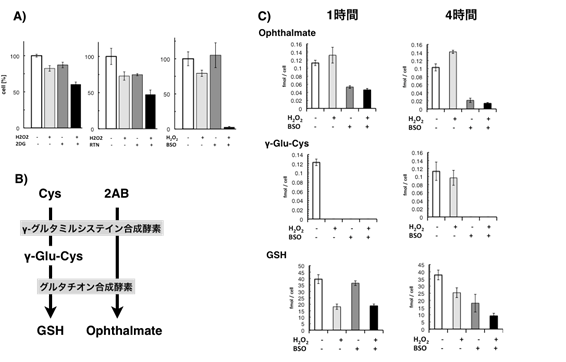
図2.
代謝経路阻害によるH2O2感受性試験とグルタチオン合成阻害時の代謝物量変化 (A)代謝経路を阻害した時のPanc-1の生存率.細胞生存率は薬剤添加24時間後にMTTで計測し,図には対照群を100とした時の生存率を示した.2DG:0.3
mM,RTN(Rotenone):1.0
μM,BSO:0.3
mM,H2O2:各0.5
mM.(B)グルタチオン合成に関わる酵素と物質.(C)グルタチオン合成経路上の代謝物の変化.薬剤添加し,1時間後と4時間後に細胞内代謝物を抽出し測定した.H2O2とBSOの濃度はそれぞれ1
mMと10
mMである.A,Cともにエラーバーは試行数3回の標準偏差を表す.
3.3. H2O2暴露したCaco-2細胞における遺伝子発現解析
H2O2暴露によって遺伝子発現が誘導される事が報告されている13.GSHやPPP,TCA回路上の物質量の変化が,遺伝子発現による制御を受けているか検討するため遺伝子発現解析を行った.解析には,20
μM-H2O2に暴露したCaco-2細胞の時系列マイクロアレイデータを用いた.対照群と比較し遺伝子発現レベルが変化している遺伝子を選択するため,log2変換したH2O2暴露群/対象群の数値が,4試行全てで0.3以上または-0.3以下になる遺伝子のみ抽出した.残った遺伝子4259個のうち,さらに代謝酵素をコードする遺伝子701個をKEGGの情報を基に選択しクラスター解析を行った(図S2).図に示す代謝経路がクラスター内で統計的に有意であったが含まれる遺伝子数はいずれも2,3個で,特定の代謝経路の遺伝子が顕著に偏在する傾向はなかった.そこで次に,グルタチオン代謝,PPP,TCA回路上の酵素遺伝子のうち4回の試行全てで検出された遺伝子を検出強度に関わらず選択した.グルタチオン代謝,PPP,TCA回路上の遺伝子はそれぞれ25個,7個,8個検出された.このうちPPP,TCA回路上の遺伝子で有意に発現が認められた遺伝子はなかった.グルタチオン代謝関連酵素はクラスター解析によってH2O2暴露直後に発現する遺伝子と30分以降に発現する遺伝子で傾向が分かれたため(図3A),それぞれのクラスターに含まれる遺伝子をグルタチオン代謝経路上で別々に示した(図3B).この結果よりH2O2暴露直後はグルタチオンの分解に関わる経路が活性化しているのに対し,30分以降にはグルタチオンの酸化還元作用(グルタチオンペルオキシダーゼとグルタチオンリダクターゼ)とグルタチオン合成(グルタチオン合成酵素)が活性化することが予測された(図3B).図1Aに示したグルタチオンの減少および回復には,遺伝子発現による調節が関与しているかもしれない.
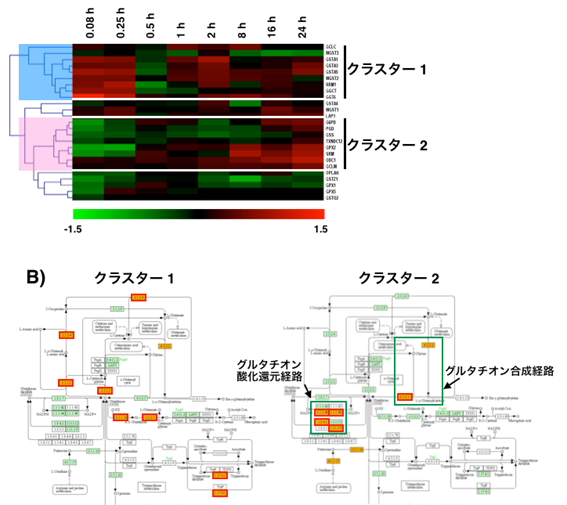
図3.
グルタチオ代謝関連遺伝子の発現 (A)グルタチオン関連酵素の遺伝子発現.全ての試行(N
= 4)で検出された遺伝子のうち,グルタチオン代謝関連酵素のみ選択しクラスタリング解析した.(B)Aで示されたクラスター1と2に含まれる遺伝子をKEGGのグルタチオン経路図に着色して示した.
3.4. 代謝物の抗酸化作用
以上の研究に加え,20種の異なる細胞株を用いたH2O2負荷試験と,それぞれの細胞株の細胞内代謝物量を測定した.各細胞株におけるH2O2のEC50(24時間後に生存細胞数が半分になる濃度)と測定代謝物の間で相関解析した結果,24の物質について0.5以上の相関があり,それには主に解糖系,TCA回路,尿素回路上の物質が含まれた.それら物質の還元作用を調べたところpyruvate,2-oxoglutarate,3PG,F6P,G6P,PRPP,FAD,Ornithine,DHAP,R5P,GSHに還元作用が見られた(図4).
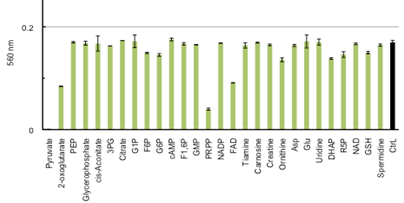
図4. H2O2耐性がん細胞株内で多かった代謝物の還元作用 各代謝物の還元作用は,30
μM-H2O2に代謝物を添加し30分間温置した後の混合液中H2O2濃度を測定することで求めた.縦軸はH2O2存在化で形成されるFe3+-XO複合体の吸光度を示し,エラーバーは試行数3回の標準偏差を表す.
4. 考察
代謝物には抗酸化作用を持つ分子が多数存在する11-14.代謝物の酸化還元作用による抗酸化機構は,酸化ストレス強度の変化に柔軟に対応すると考えられ,本研究ではH2O2暴露に対するPanc-1細胞の細胞内で大きく代謝変動する物質および代謝経路を調べ,そのH2O2感受性への関与と調節機構を調べた.
Panc-1細胞内では,GSHおよびPPP,TCA回路上の代謝物質がH2O2暴露直後に大きく変動し,その後次第にH2O2暴露前の物質量に近づく変動を示した(図1).GSHは直接あるいは酵素を介してH2O2を無毒化する.従って細胞内GSHの低下は,H2O2の添加によりGSHが消費されたためと考えられる.また,PPPはGSH濃度を維持する主要な経路であるが,図1Aに示したPPP代謝物の増加は,GSHの減少に従うPPP代謝の活性化を示している.酵母の実験では,H2O2暴露後,遺伝子発現に先行してPPP代謝物質が変動することが示されており8,がん細胞でも同様の機構でPPPが活性化していると考えられる.TCA回路では,cis-acconiate→isocitrateの反応を媒介するアコニターゼがH2O2によって一時的に不活性化されることが報告されており15,16,その結果TCA回路上流の物質が蓄積し,逆に下流の代謝物量が消費されたと考えられる.TCA回路を有すミトコンドリアは,細胞内ROSの主要な生産場所であり,TCA回路代謝を抑制により,酸化的リン酸化によるROSの生成を防いでいるのかもしれない.
GSHおよびPPP,TCA回路上の代謝変動がH2O2に対する防御機構であると考え,グルタチオン合成経路,PPP,TCA回路を阻害した際のH2O2感受性を調べた結果,PPP,TCA回路の阻害による感受性の上昇は見られず,グルタチオン合成経路が阻害された時のみH2O2に対する耐性が失われた(図2A).このことより高濃度のH2O2暴露下でPanc-1が生存するために,グルタチオン合成代謝が必要な抗酸化機構の一つであると示唆された.グルタチオン合成阻害の有無によるメタボローム解析の結果,4時間後にはH2O2負荷群におけるγ-Glu-Cys,GSHがともにBSO
- H2O2添加群に比べ高く,グルタチオン合成経路がGSH量の速やかな増加につながることが示唆された(図2C).一方,PPPおよびTCA回路上の物質はBSOの有無に関わらず同様の変化を示しており(図S1),グルタチオンの減少およびH2O2感受性の変化とは関係がない代謝変動であることが示唆された.
マイクロアレイデータの解析では,グルタチオン代謝経路においてH2O2暴露直後に発現する遺伝子群と徐々に発現する遺伝子群が存在することが予測された(図3).H2O2暴露直後はグルタチオン分解経路が活性化されており,何らかの理由でアミノ酸要求が高まっているのかもしれない.30分以降にはグルタチオンの酸化還元経路と合成経路上の酵素発現レベル上昇している事から,H2O2暴露に対し,酸化ストレス除去作用およびその反応で利用されるグルタチオンの供給が促進されると考えられる(3B).
本研究では,培養がん細胞においてH2O2暴露に対し大きく変動する代謝物を調べ,その代謝物(経路)のH2O2感受性への関与と,代謝調節機構について検討した.本研究を通し高濃度のH2O2暴露に対しPanc-1が生存するためには,グルタチオン合成の機能が必要である事が確認された.GSHはH2O2添加直後に激減し,30分以降に回復傾向を示したが,この変化にはH2O2によるGHS消費と,その後のグルタチオンde novo合成によるGSH量の増加が寄与していることが示唆された.また,グルタチオン代謝は遺伝子発現で制御されている事が予測された.今回,グルタチオン合成の酵素を阻害してH2O2感受性を評価しているので,遺伝子発現との関係をより明確に確かめるためには,発現レベルで代謝酵素を制御してH2O2感受性評価をする必要がある.PPPとTCA回路の関連物質もまたH2O2暴露直後の物質量が大きく変動したが,これら経路はH2O2感受性への関与は低い事が示され,またこれら経路がH2O2負荷後遺伝子発現による調節を受けている可能性も低いことが予測された.先行研究の報告からこの代謝物変動には酵素の活性変化が関与していると考えられる.一方,様々ながん細胞にH2O2を負荷した実験では,H2O2耐性の高い細胞が,他の細胞に比べPPPやTCA回路の関連物質量が多いことが分かっている.今回は外部からの酸化ストレス負荷であったが,内部で酸化ストレスを発生させた場合には,エネルギー代謝の果たす機能が何らかの形で細胞の酸化ストレス耐性に寄与しているかもしれない.
参考文献
サプリメンタルデータ
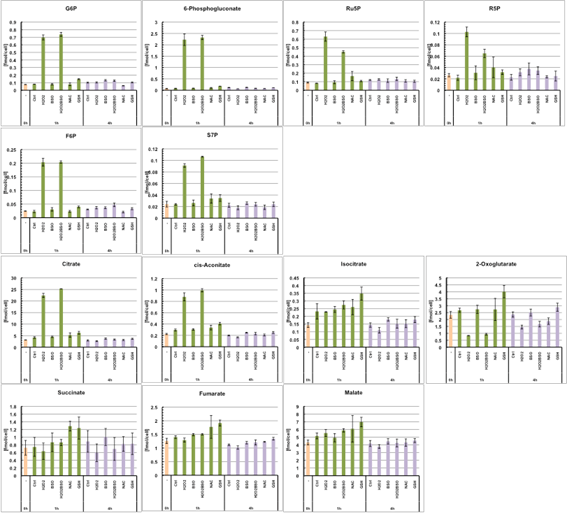
図S1.
酸化物質および抗酸化物質添加によるエネルギー代謝物質量変化 薬剤添加前と添加後1時間と4時間で細胞内代謝物を抽出しメタボローム測定した.Ctrl(対照群),H2O2:1
mM,BSO:10
mM,BSOH2O2(BSO+H2O2),N-acetyl-cysteine(NAC):10
mM,GSH:10
mM.エラーバーは試行数3回の標準偏差を表す.
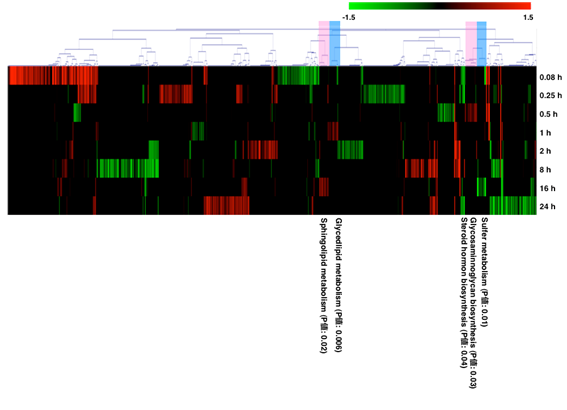
図S2.
代謝酵素遺伝子のクラスター解析 4試行全てで発現しておりかつ対照群と比較し発現強度が異なる代謝酵素遺伝子701個を抽出し,ピアソン相関を基底としクラスター解析した.解析に用いた全遺伝子に対するクラスター内遺伝子のエンリッチメント解析を行い,統計的に有意な代謝経路についてのみ図中に示した.