2006年度 SFC研究所プロジェクト補助 研究概要報告書
分子レベルモデリングによる脳情報処理の研究
慶應義塾大学環境情報学部 専任講師
菊地進一
研究の概要
我々はこれまでに報告されてきた実験科学的な拘束条件を用いて、シグナル伝達の代数的モデリングを行ってきた。また、このようなモデリング解析の結果、生化学的な研究へのフィードバックを行い実証実験を行ってきた。現在、ミクロレベルとマクロレベルでの研究手法の乖離を埋めるようMRSを用いた研究を行い、分子レベルでの変化が脳全体にどのような変化を与えるのかを調べている。また遺伝子情報解析から予測される結果も用いながら、脳情報処理の全体的な理解につなげていきたいと考えている。今年度の成果として、ミクロレベルでの情報処理機構を計算機によって明らかにする方法論を発表する機会を得た。
研究の背景
本課題の目的は脳・神経系の研究において、ミクロレベルとマクロレベルのそれぞれで得られるような断片的な研究成果を結びつけることによって、新たな全体的知見を得ることにある。
我々は神経細胞におけるシグナル伝達のシミュレーション研究から推定される実験科学的な検証や、生化学データから機械学習理論を用いたダイナミクス推定やバイオマーカー探索に必要な理論構築に関して研究を行ってきた。これまでの研究は、シグナル伝達という分子生物学的なミクロレベルでのモデリングに主眼を置いていた。ミクロレベルの利点としては、メカニズムの理解や薬剤開発につながりやすいことなどが挙げられる。しかし、欠点としては脳というマクロレベルでのシステムを理解の対象と考えた場合、分子・細胞レベルでの知見が全体の結果をどこまで反映しているのかは疑問であり、かなり長期的なスパンでの研究が必要となってくる。
一方、fMRI/MRSに代表されるように、脳内メタボローム(代謝物質濃度の変化)から機能アトラスを作成しようというアプローチは、分子的メカニズムをブラックボックスとするものの統合的な機能に直結した研究である。これらのアプローチの差異は「ミクロとマクロ」というモデル粒度の違いという文脈ではなく、「タンパク質と代謝物質」という計測対象の分子構造の違いにある。従来の分子生物学の分野で重要視されてきたタンパク質間相互作用におけるシグナル伝達の表現だけでなく、代謝物質との相互的な連関として考慮したものをMR装置で測定すれば、ミクロレベルでの変化・意味づけをマクロレベルで観察できる枠組みを提案できるということを意味する。図1では、丸で囲まれた物質がタンパク質、菱形で囲まれた物質が代謝物質である。これらの代謝物質は、図2のように核磁気共鳴による脳マクロ測定装置によって測定可能である。
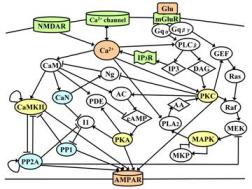
図1 神経細胞のシグナル伝達モデル(代謝物質を含む)
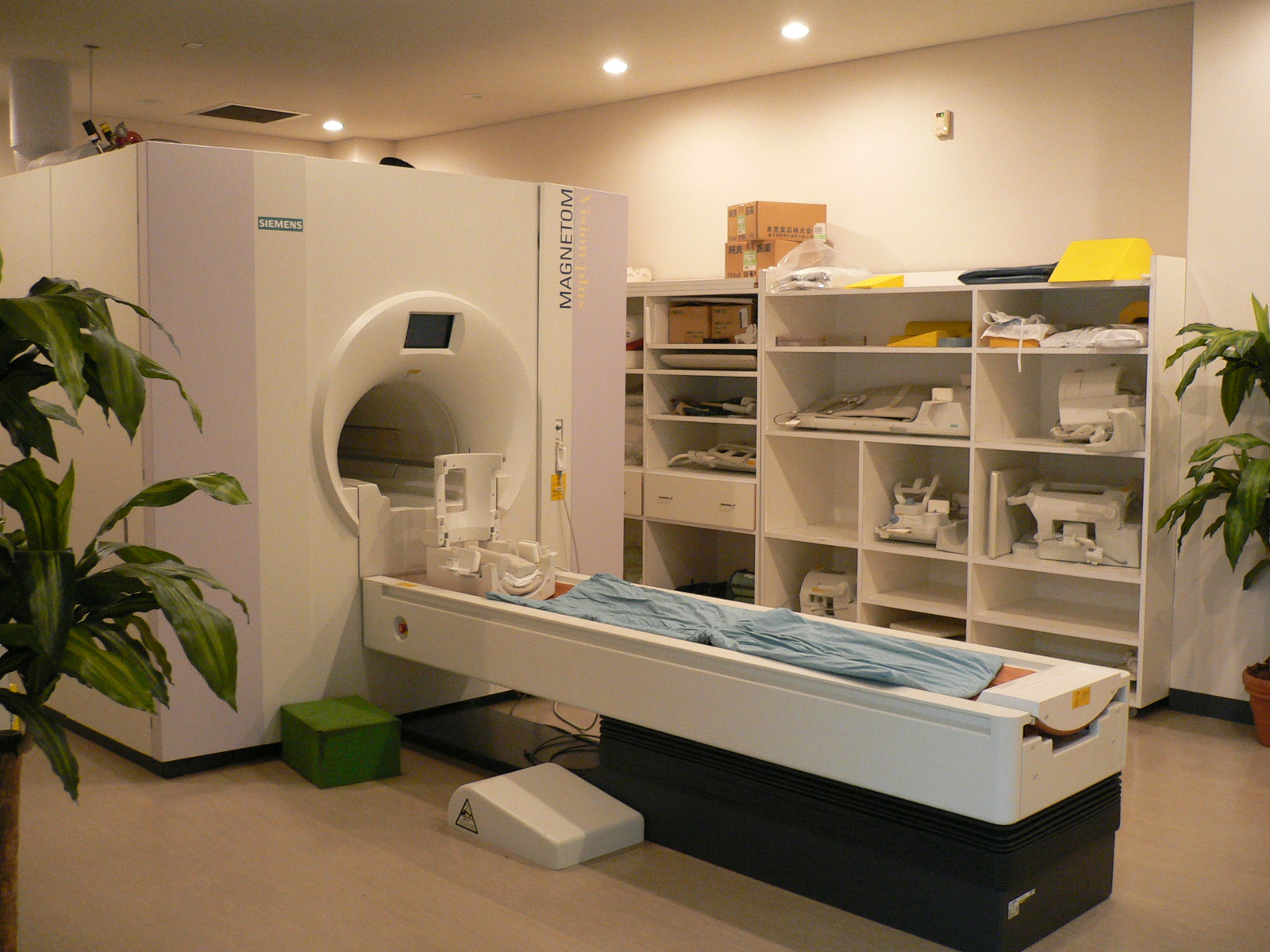
図2 核磁気共鳴装置によって脳内代謝物質の濃度を測定する
我々は、ある障害をもっている者と健常者との間で脳内メタボロームの差がどのようになっているかをMRSを用いて測定している。実際にアルツハイマー病ではNAAの総和濃度が半分近くになっており、バイオマーカーとして早期臨床診断に応用化が進んでいる。また、カフェィンなどの摂取前後でどのように視覚野の活性が変化するかを調べている。これらのように、脳科学研究でミクロレベルとマクロレベル結びつけるような方法論は、世界的にも珍しい取り組みである。
また各遺伝子の情報学的な特徴解析の研究を行っており、いくつかの遺伝子において統計的な特徴が共通して観察されることが示唆されつつある。多様な変量に着目することでヒト脳の全体論的な理解につなげられたらと考えている。
研究成果
我々は神経細胞におけるシグナル伝達のモデリング研究を行ってきたが、主に分子レベルでのキネティクス情報で表現された連立微分方程式モデルである。これを用いて、突起伸長、神経可塑性、神経細胞死という3つの異なるステージの表現に取り組んできた。しかし、これまでの方法には速度情報が得られないと全くモデリングができなくなるという問題点があった。そこで、我々はネットワーク情報だけからでも最大限に解析結果を得ようとする化学量論係数に基づく経路解析手法を開発した。これは化学量論行列のカーネル空間を求めることによって極限経路を求め、よく使われている経路やスイッチとなるような構造を導き出せる手法である。
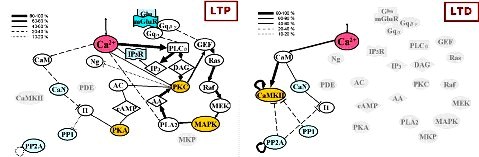
図3 神経可塑性における伝達効率の違い
fMRI/MRSの研究においては、時間軸を付与することで時刻0を作って、異なる実験条件で比較検討が可能になったことを利用して、視覚野で機能変化による代謝物質濃度の変化を観察している。これまでの研究では代謝物質の総和濃度は比較的安定していると報告されており、どのような条件で変化が起きるのかを詰めていくことができれば興味深い。また、シミュレーションモデルとしてミクロなシグナル伝達とマクロな代謝活動の総和を結びつける基盤研究となりうると考えている。
遺伝子の特徴解析の研究に関してはいくつかの距離測度を得ている。具体的には、ガン、喘息、糖尿病、神経疾患、心疾患に関しては70%程度の精度で予測できることが示唆されている。機械学習を用いたこのような方法論から、アルツハイマー病などの神経疾患の説明変数を遺伝子レベルで明らかにしていくことを通して、脳科学の研究に多角的に迫っていけるのではないかと考える。
まとめ
これまではシグナル伝達および代謝のシミュレーションの研究は独立して行われることが多かった。我々の系はそれらを融合させる意義を見出せる適切な系であると同時に、ミクロとマクロの融合の方法論を提示できると考えている。これが本申請課題の最も重要なアイデアである。
MRを用いた研究は国立身体障害者リハビリセンターとの共同研究です。ここに感謝の意を表します。
関連文献
- K. Mori, R. Saito, S. Kikuchi, M. Tomita (2007) Inferring rules of E. coli translational efficiency using an artificial neural network. Biosystems, in press.
- Y. Matsuzaki, S. Kikuchi, M. Tomita (2007) Analysis of CheA-CheYp affinity and adaptation error in bacterial chemotaxis. IPSJ Trans on Mathematical Modeling and its Application, vol.48, no.TOM16, in press.
- Y. Matsubara, S. Kikuchi, M. Sugimoto, M. Tomita. (2006) Parameter estimation for stiff equations of biosystems using radial basis function networks. BMC Bioinformatics, 7:230, 1-11.
- S. Kikuchi, Y. Matsubara, K. Yazawa, H. Yamanami, M. Tomita, K. Oka. (2006) Simulation and imaging of intracellular signal transduction system. JSST Journal, 25(1), 29-35, 2006.
- Y. Matsubara, S. Kikuchi, M. Sugimoto, K. Oka, M. Tomita. (in revision) Algebraic method for the analysis of signaling crosstalk.
- K. Ishii, S. Nakamura, M. Morohashi, M. Sugimoto, Y. Ohashi, S. Kikuchi, M. Tomita. (in revision) Comparison of metabolite production capability indices generated by network analysis methods.
- Y. Matsuzaki, S. Kikuchi, M. Tomita (in review) Analysis of CheA-CheYp Affinity and adaptation precision in bacterial chemotaxis.


