2016年度 SFC研究プロジェクト補助 研究概要報告書
研究課題名:
人工的な遺伝子回路を組み込んだ細胞の数理モデル化
所属:環境情報学部
氏名:内藤泰宏
概要
細胞に人工的に設計した遺伝子回路を組み込んで 新たな機能を付与する合成生物学テクノロジーが急速に進歩している。「細胞内での ものづくり」ともいえる合成生物学による細胞加工プロセスの効率化・高速化に資することを目的として、遺伝子回路の数理モデリングおよびシミュレーション技術を開発する。
背景
近年、遺伝子工学などのバイオテクノロジーを利用して、人工的に設計した遺伝子回路を細胞中に組み込み、細胞に新たな機能を付与する合成生物学 synthetic biology と呼ばれる分野が急速に進展している。従来の遺伝子工学が、もともと細胞が持っている機能に対して破壊、増幅、修飾を施すことで、生命システムの理解や、医学・農学・工業利用の促進をめざしたのに対し、合成生物学が一線を画すのは、基盤として利用する細胞が本来まったく備えていなかった機能を、フルスクラッチでゼロから細胞内に組み立てる(=合成する)点にある。これは、萌芽的な「細胞内でのものづくり」技術ともいえるだろう。_特に最近の数年間、合成生物学の技術は長足の進歩を遂げてきており、今後ますます加速していくものと思われる。急速に技術開発が進んでいるとはいえ、現在はまだ「おもちゃ」レベルの遺伝子回路を合成するのが精一杯である。現時点で細胞内に合成された回路の例には、単純な電子部品を模したものが多く、例えば、種々の論理ゲートとしてふるまう細胞を合成した研究、イベントが起こった回数を「記憶」する細胞を合成した研究などが報告されており、最先端の成果として Science 誌をはじめとするトップジャーナルに採択されている。
細胞内に電子部品を模した回路を合成する技術は蓄積しつつある一方で、細胞の集団に電子回路のような振る舞いをさせるのは原理的に非常に難しい。細胞の集団と、電子回路(電子部品の集合)には本質的な差違がある。電子回路では、厳密な設計に沿って個々の電子部品が接続され、非常に疎なネットワークを構成している。そして、回路全体は決定論的にふるまう。これに対し、培地中の細胞集団を構成する個々の細胞どうしのコミュニケーションを個別に制御することは、現在の技術では不可能である。細胞は、環境中に分泌する化学物質や、細胞膜の持つ電位によって、自身の状態(ステイタス)を伝達することができるが、化学物質や膜電位といったシグナルは、近隣のすべての細胞に拡散や接触によって伝達される。細胞集団において、細胞は密なネットワークを構成しており、しかもそのネットワークは、局所的には均一、大局的には不均一である。こうした集団に起こる現象は、電子回路のような精密に制御されたカスケード状の情報伝達ではなく、自己組織化的なパターンの出現である。また、集団レベルで現れる結果は必ずしも決定論的とは限らず、確率論的な側面が巨視的なレベルにまで波及する場合がある。
目的
合成生物学テクノロジーによって樹立される遺伝子回路を搭載する細胞(以下、細胞素子)を利用するためには、こうした細胞素子を要素とする集団の振る舞いを予測し、制御する技術の確立が欠かせない。研究代表者の内藤は、2015年度の特別研究期間中に、研究分担者の谷内江が主宰する東京大学先端科学技術研究センターの合成生物学研究室で合成生物学の研究を開始し、現在も共同して研究を進めている。_東大先端研では、設計した遺伝子回路を実際に細胞に組み込んで細胞株を樹立し、その特性の諸側面を計測する wet の研究を主に遂行している。これと平行してSFCでは dry の側面すなわち、樹立した細胞素子および、それらを要素とする細胞集団を数理モデル化し、シミュレーションによって細胞素子ならびに細胞集団のふるまいを予測する計算生物学研究の遂行に着手している。
今回のプロジェクト補助研究の目的は、SFCで遂行する計算生物学研究の達成である。
具体的な達成目標として、以下の2項目を掲げる。
(1) 2015年度中に樹立に成功し、その主要な機能の測定も終えている酵母細胞を対象に、それらの細胞のふるまい(表現型の時間発展)を動的に再現可能な数理モデルを構築し、数値シミュレーションを行う。
上記 (1) の細胞モデルを構成要素とする細胞集団モデルを構築し、液体培地、寒天培地などの諸条件における細胞集団の時間発展を数値シミュレーションによって予測する。
遺伝子回路の設計
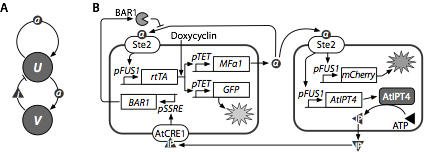
図1 (A) Turingの回路 要素 U は 刺激因子 a を介して U 自身と要素 V を刺激(促進)し、V は 抑制因子 i を介して U を抑制する。この回路は、a と i の強度のバランスによって双安定性を呈しうる。_(B) 細胞間コミュニケーション回路の設計 U, V をそれぞれ細胞として実現する。詳細はテキストを参照。
現在、具体的に作成を進めているのは、細胞間コミュニケーションによる空間・時間的パターンの創出をめざした設計で、1952年にTuringが提唱したTuring patternを基盤としている(図1A)。_本研究のために昨年度までに設計、樹立した酵母細胞には、Turing patternを実現するための遺伝子回路を組み込んである(図1B)。細胞 U(図1B左)は、細胞 U 自身と細胞 V の反応を強化する因子 α を分泌する回路を組み込んだ(MFα1遺伝子など)。また、信号の強度に応じて緑色蛍光タンパク質(GFP)を発現する回路も組み込んであるため、顕微鏡下の緑色蛍光で信号強度を確認できる。細胞 V(図1B右)は、細胞 U を抑制する因子 IP(イソペンテニルアデニン)を分泌する。IPの分泌は、細胞 V が感受するαの量に応じて増加する。細胞 V にはIP分泌の強度に応じて赤色蛍光タンパク質(RFP)を発現する回路を組み込んだ。_細胞 U、細胞 V ともに、出芽酵母細胞として2015年度中に数株を樹立し終えている。また、完成した細胞ならびに合成作業の中間段階の細胞のいくつかについて、環境中のαおよびIPの濃度について異なる72~96条件下で、細胞の蛍光強度の時系列計測を実施済みである。
細胞 Uのα因子への応答の数理モデル化
本研究では2種類の細胞のうち細胞 U の計測結果に基づく数理モデル化を試みた。
細胞 U から、pTET-MFα1 を欠失した細胞UΔMFα1 のα因子への応答を図2に示す。細胞 U は、α因子に応答して自らもαを産生するポジティブフィードバック機構を有するが、細胞UΔMFα1 はこのポジティブフィードバックを欠損しており、α因子に応答して、GFP を発現するだけである。この細胞のα因子への応答を計測することで、任意の細胞外α因子濃度に対して、細胞内回路がどういったダイナミクスでGFPを賛成するかを知ることができる。
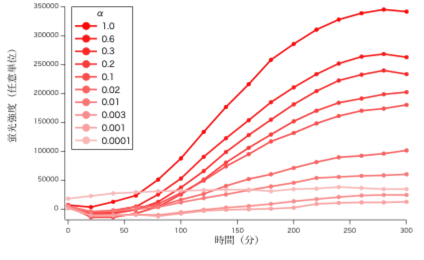
図2 細胞 UΔMFα1のα因子への応答 さまざまな濃度(100 pM~1 _M)のα因子に対する細胞 UΔMFα1 の発する緑色蛍光強度の時間変化。時刻0で、α因子への曝露を開始している。蛍光強度は、α因子に曝露しなかった細胞の蛍光量の時間変化を対照として標準化した相対値である。
図2より、α因子濃度の増加に応じて、蛍光強度が増強していることがわかる。また、応答に要する時間は、α因子濃度に大きく影響されていないことがわかる。
これをシグモイド関数に近似して以下のモデル式(1)を得た。
![]()
![]() 式(1)
式(1)
ただし、I は蛍光強度、αはα因子の濃度、t は時刻、Ri は蛍光強度の増加率を表す。
式(1) の計算結果と計測値の比較を図3に示す。
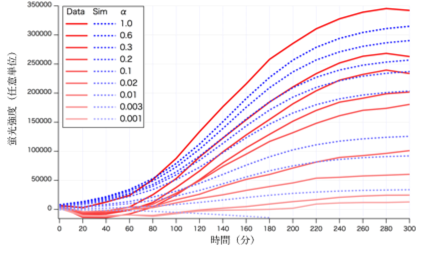
図3 モデル式による計測値の再現 赤の実線が計測値、青の点線がモデル式の計算結果である。
モデル式は、概ね細胞 UΔMFα1のα因子への応答を再現しているが、詳細に再現の程度を知るには、さらなる解析が必要である。
最終的には、時刻 t を陽に含まない微分方程式系としてモデルを得て、細胞集団の振る舞いを予測したい。シグモイド関数からは、これと等価な微分方程式(ロジスティック方程式)を得ることができる。この変換を規範として、モデル式(1) とほぼ等価な微分方程式 (2)を得た。
![]()
![]() 式(2)
式(2)
α因子のポジティブフィードバック機構の数理モデル化
次に、α因子に応答してα因子を賛成するポジティブフィードバック機構を搭載した細胞へと数理モデルの拡張を試みた。
図4にポジティブフィードバック機構を含む細胞 U のα因子への応答を計測した結果を示す。
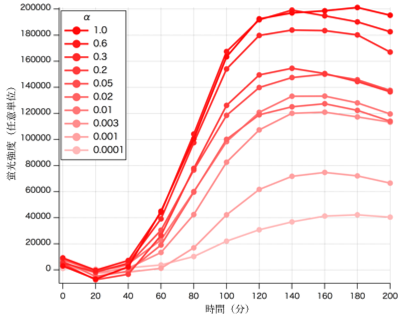
図4 細胞 Uのα因子への応答 さまざまな濃度(100 pM~1 _M)のα因子に対する細胞 U の発する緑色蛍光強度の時間変化。時刻0で、α因子への曝露を開始している。蛍光強度は、α因子に曝露しなかった細胞の蛍光量の時間変化を対照として標準化した相対値である。
構築した蛍光強度のα因子への応答モデルと図4の計測値の対応から、各計測点における総α因子濃度(外部から与えたα因子と、ポジティブフィードバックによって自ら産生・分泌したα因子の総和)を推定した(図5)
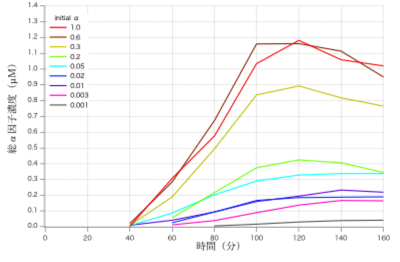
図5 総α因子濃度の推定値 α因子への応答モデル(式(2))と細胞 U の計測値(図4)より、各時点における総α因子濃度を推定した。凡例に示した数値は、外部から与えた時刻0におけるα因子濃度(_M)。
図5より、ポジティブフィードバック機構によるα因子産生量の時系列もまたロジステッィクモデル様のダイナミクスを示すことが示唆されたため、αの時間変化もロジスティック方程式で近似できるものと仮定してモデル化を試みることにした。
ロジスティック方程式の2つのパラメータを、遺伝的アルゴリズムを用いて近似したが、図5の時系列を良好に再現するパラメータセットを得ることはできなかった。
展望
本研究では、時系列の概形から、類似した軌跡を呈するシグモイド関数、ロジスティック方程式への近似を試みた。このトップダウン形式のアプローチによって、α因子への応答においては計測値を再現できるモデルを構築することができた。しかし一方で、ポジティブフィードバック機構のモデル化では、このアプローチは奏功しなかった。
これに対するボトムアップ形式のアプローチは、回路設計を基盤に、素過程である分子反応を質量保存則などでモデル化し、その総和として蛍光強度などの表現型(出力)をするものとなる。ボトムアップアプローチによるモデルは原理的に変数の数が大幅に増えるため、本研究では採用しなかったが、ポジティブフィードバック機構のモデル化に際しては、ボトムアップアプローチを採用したモデル化を試みたい。